配位滴定法的滴定曲线
发布时间:2017-09-01
在EDTA配位滴定中,随着配位剂EDTA的不断加入,被滴定的金属离子浓度[M]不断减小,达到化学计量点附近时,溶液的pM发生突跃。因此,讨论滴定过程中金属离子浓度的变化规律(即滴定曲线)及影响pM突跃的因素是极其重要的。
绘制滴定曲线时,必须要计算随着EDTA加入量的不同,pM相应的变化情况。在配位滴定法中,除了主反应外,还有涉及EDTA、金属离子M和产物MY的各种副反应。
对于不易水解且不与其他配位剂配位的金属离子,只需考虑EDTA的酸效应,引入aY(H)对KMY进行修正;对于易水解的金属离子,还应考虑水解效应,引入aY(H)和aM(oH)对KMY修正;对于易水解且与辅助配位剂配位的金属离子,则应考虑aY(H)和aM修正KMY。然后利用条件稳定常数计算化学计量点和化学计量点后被滴定金属离子的浓度,并求得pM,从而根据pM随着滴定剂EDTA的变化关系绘制滴定曲线。
需要说明的是,配位滴定的滴定曲线仅能说明在不同pH条件下,金属离子浓度(pM)在滴定过程中的变化情况,而用于选择指示剂的实用性不大。
1、单一离子体系准确滴定的条件
在配位滴定法中,通常使用金属离子指示剂来指示终点,由于人眼判断颜色的局限性,目测终点与化学计量点pM的差值ApM一般为±(O.2~0.5)。若允许相对误差为0.1%,金属离子的分析浓度为c,根据终点误差公式可推导出
lgcK’MY≥6 (4―17a)
通常将式(4―17a)作为能否用配位滴定法准确滴定单一金属离子的判别式。若能满足该条件,则可得到相对误差小于或等于O.1%的分析结果。若金属离子的分析浓度为
O.01mool・L-1,代入式(4―17a)可得
LgK’MY≥8 (4―17b)
2、配位滴定中酸度的控制和酸效应曲线
在配位滴定中,假设配位反应中除了EDTA的酸效应和M的水解效应外,没有其他副反应,则溶液酸度的控制是由EDTA的酸效应和金属离子的羟基配位效应决定的。根据酸效应可以确定滴定时允许的最低pH值(最高酸度),根据羟基配位效应可以估算出滴定时允许的最高pH值(最低酸度)。从而得出滴定的适宜pH范围。
最高酸度(最低pH)的确定,将式(4―16)和式(4―17a)结合可得:
lgc+lgKMY―lgaY(H)≥6
1gdY(H)≤1gc+1gKMY一6 (4―18)
由式(4―18)可计算出lgaY(H),再查表4―2,可求得配位滴定允许的最低pH(pHmin)。
由式(4―18)可知,不同金属离子由于其lgKMY不同,滴定时允许的最低pH值也不同。
将金属离子的lgKMY值与最低pH[或对应的lgaY(H)与最低pH]绘制成曲线,称为EDTA的酸效应曲线或林邦(Ringbon)曲线,如图4―6所示。图中金属离子位置所对应的pH值,就是滴定该金属离子(c=O.01mool・L-1)时所允许的最低pH值。
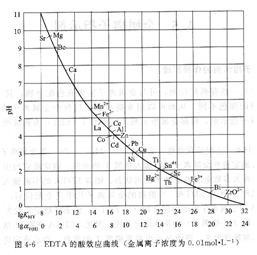
从林邦曲线上可以得出如下信息:
① 曲线上可以查出单独滴定各种金属离子时允许的最低pH值。例如FeY-配合物的lgKFeY一=25.1,查图4―6得到pH>l,即在强酸性溶液中滴定;而CaY2-的滴定条件须在pH≈7.8的弱碱性溶液中滴定。
②通过曲线可知在一定范围内哪些离子可以被滴定,哪些离子对滴定有干扰。曲线下方的离子干扰曲线上方离子的滴定。
③从曲线还可以看出,利用控制酸度的方法,在同一溶液中可以连续滴定哪几种离子。
在满足滴定所允许的最低pH值的条件下,增大溶液的pH值,lgay(H)减小,则lgK’MY增大,配位反应的完全程度也增大。但是若溶液的pH太高,金属离子尤其是高氧化值的金属离子易发生水解或形成羟基配合物,从而影响配位反应的进行。因此,还应考虑不使金属离子水解或发生羟基配位反应的pH条件。一般粗略计算时,可直接利用金属离子氢氧化物的溶度积常数求得。
参考资料:分析化学







