沉淀的类型和沉淀的形成
发布时间:2017-09-01
沉淀的类型:
沉淀按其物理性质的不同分为两类:一类是晶形沉淀;另一类是无定形沉淀。无定形沉淀又称为非晶形沉淀或胶状沉淀。BaSO4是典型的晶形沉淀,Fe203・H2O是典型的无定形沉淀。AgCl是一种凝乳状沉淀,按其性质来说,介于两者之间。它们的最大差别是沉淀颗粒的大小不同。颗粒最大的是晶形沉淀,其直径为O.1~1μm;无定形沉淀的颗粒很小,直径一般小于0.02μm;凝乳状沉淀的颗粒大小介于两者之间。从整个沉淀外形看,由于晶形沉淀是由较大的沉淀颗粒组成的,内部排列较规则,结构紧密,所以整个沉淀所占的体积比较小,极易沉降于容器的底部。无定形沉淀是由许多疏松聚集在一起的微小沉淀颗粒组成的,沉淀颗粒的排列杂乱无章,其中又包含大量数目不定的水分子,所以是疏松的絮状沉淀,整个沉淀体积庞大,不像晶形沉淀那样很好地沉降在容器的底部。
在重量分析中,最好获得晶形沉淀。晶形沉淀有粗晶形沉淀和细晶形沉淀之分,如MgNH4 P04是粗晶形沉淀,BaSO4为细晶形沉淀。
沉淀的形成:
沉淀的形成一般要经过晶核形成和晶核长大两个过程。将沉淀剂加入试液后,当形成沉淀的离子(构晶离子)浓度幂的乘积大于该条件下此沉淀的溶度积时,离子通过相互碰撞而聚集成微小的晶核,当晶核形成后,溶液中的构晶离子向晶核表面扩散,并沉积在晶核上,晶核就逐渐长大成沉淀颗粒。这种由离子形成晶核,再进一步聚集成沉淀颗粒的速率称为聚集速率。在聚集的同时,构晶离子在一定晶格中定向排列的速率称为定向速率。生成沉淀的类型是由聚集速率和定向速率的相对大小所决定的。如果聚集速率大,定向速率小,离子能很快地聚集生成沉淀颗粒,但却来不及进行晶格排列,则得到无定形沉淀。反之,离子较缓慢地聚集成沉淀,有足够时间进行晶格排列,则得到晶形沉淀。
聚集速率主要由沉淀时的条件所决定,其中最重要的是溶液中生成沉淀物质的相对过饱和度。槐氏(von Weimarn)在深入研究影响沉淀颗粒大小的因素基础上,提出晶体颗粒形成速率与过饱和度关系的经验公式:
υ=K(Q―s)/s (7―10)
式中,υ为形成沉淀的初始速率(聚集速率);Q为加入沉淀剂瞬间沉淀物质的浓度;s为开始沉淀时沉淀物质的溶解度;Q―s为沉淀开始瞬间的过饱和度;(Q―s)/s为沉淀开始瞬间的相对过饱和度;K为比例常数,它与沉淀的性质、温度、溶液中存在的其他物质等因素有关。
从式(7―10)可清楚看出,溶液的相对过饱和度大,聚集速率大,易生成无定形沉淀;相对过饱和度小,则聚集速率小,有利于生成晶形沉淀。若要聚集速率小,必须使相对过饱和度小,那么就要求沉淀的溶解度s大,加入沉淀剂瞬间沉淀物质的浓度不太大,就可能获得晶形沉淀。反之,若沉淀的溶解度很小,瞬间生成沉淀物质的浓度又很大,则形成无定形沉淀。例如]3aSO4通常情况下为晶形沉淀,但在浓溶液(如0.75~3mol・L-1)中进行沉淀时,也会形成无定形沉淀。
定向速率主要决定于沉淀物质的本性。一般极性强的盐类,如MgNH4PO4・6H2 O、BaSO4、CaC2O4等,具有较大的定向速率,易形成晶形沉淀。而氢氧化物具有较小的定向速率,因此其沉淀一般为非晶形。特别是高价金属离子的氢氧化物,如Fe(OH)3、Al(OH)3等,结合的OH-愈多,定向排列愈困难,定向速率愈小。且这类沉淀的溶解度极小,聚集速率很大,加人沉淀剂瞬间形成大量晶核,使水合离子来不及脱水,便带着水分子进入晶核,晶核又进一步聚集起来,因而一般都形成质地疏松、体积庞大、含有大量水分的非晶形胶状沉淀。二价金属离子(如Mg2+、Zn2+、Cd2+等离子)的氢氧化物,如果条件适当,可以形成晶形沉淀。金属的硫化物一般都比其氢氧化物溶解度小,是非晶形或胶状沉淀。
由此可见,沉淀的类型,不仅决定于沉淀的本性,也决定于沉淀进行时的条件,若改变沉淀条件,也可能改变沉淀的类型。
影响沉淀纯度的主要因素:
在重量分析中,要求获得的沉淀是纯净的。但是,沉淀是从溶液中析出的,总会或多或少地夹杂溶液中的其他组分。因此,必须了解沉淀生成过程中混入杂质的各种原因,找出减少杂质混入的方法,以获得符合重量分析要求的沉淀。
共沉淀现象:
当一种沉淀从溶液中析出时,溶液中的某些可溶性杂质会被沉淀带下来而混杂于沉淀中,这种现象称为共沉淀。
(1)表面吸附在沉淀中,构晶离子按一定的规律排列,在晶体内部处于电荷平衡状态;但在晶体表面,离子的电荷则不完全平衡,因而会导致沉淀表面吸附杂质。这些抗衡离子中,通常有少部分被Ag+较强烈吸引,也处于吸附层中,第一吸附层和第二吸附层共同组成沉淀表面的双电层,从而使电荷达到平衡。双电层能随沉淀一起沉降,从而沾污沉淀。这种由于沉淀的表面吸附所引起的杂质共沉淀现象叫表面吸附共沉淀。
图7―1是AgCl沉淀表面吸附杂质的示意图。
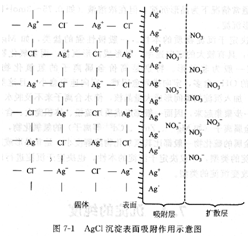
沉淀表面吸附离子具有选择性,一般情况下,由于沉淀剂过量,吸附层首先吸附的是构晶离子, 此外,沉淀表面吸附杂质的量还与下列因素有关。
①与沉淀的总表面积有关 同量的沉淀,颗粒愈小,表面积愈大,吸附的杂质量也就愈多。无定形沉淀的颗粒很小,比表面很大,所以表面吸附现象特别严重。
②与溶液中杂质的浓度有关溶液中杂质离子浓度越大,被沉淀吸附的量越多。
③与溶液的温度有关 因为吸附作用是一个放热的过程,因此,溶液温度升高时,吸附杂质的量将减少。
(2)生成混晶
每种晶形沉淀,都有其一定的晶体结构。如果试液中杂质与沉淀具有相的晶格,或杂质离子与构晶离子具有相同的电荷和相近的离子半径,杂质将进入晶格排列中形成}昆晶。由于杂质是进入沉淀内部的,通常用洗涤或陈化的方法难以除去。为避免混晶的生成,最好事先将这类杂质分离除去。
(3)吸留和包藏
在沉淀过程中,如果沉淀生成太快,则表面吸附的杂质离子来不及离开沉淀表面就被沉积上来的离子所覆盖,这样杂质就被包藏在沉淀内部,引起共沉淀,这种现象称为吸留。吸留引起共沉淀的程度,也符合吸附规律。有时母液也可能被包藏在沉淀之中,引起共沉淀。
这类共沉淀不能用洗涤的方法将杂质除去,可以采用改变沉淀条件、陈化或重结晶的方法来避免。
当沉淀析出后,在放置过程中,溶液中某些杂质离子可能慢慢沉淀在原沉淀上面,这种现象称为后沉淀。这种情况大多发生在该组分形成的稳定的过饱和溶液中。
后沉淀所引入的杂质量比共沉淀要多,且随着沉淀放置时间的延长而增多。因此为防止后沉淀现象的发生,某些沉淀的陈化时间不宜过久。
提高沉淀纯度的措施:
由于共沉淀及后沉淀现象,使沉淀被沾污而不纯净。为了提高沉淀的纯度,减小沾污,可采用下列措施:
① 择适当的分析步骤 。
②选择合适的沉淀剂。
③降低易被吸附杂质离子的浓度。
④选择适当的沉淀条件针对不同类型的沉淀,选用适当的沉淀条件。
⑤再沉淀将已得到的沉淀过滤后溶解,再进行第二次沉淀。第二次沉淀时,溶液中杂质的量大为降低,共沉淀或后沉淀现象自然减少。这种方法对于除去吸留和包藏的杂质效果很好。有时采用上述措施后,沉淀的纯度提高仍然不明显,则可对沉淀中的杂质进行测定,再对分析结果加以校正。
在重量分析中,共沉淀或后沉淀现象对分析结果的影响程度,随具体情况的不同而不同。如果沉淀中夹有Bacl2,最后按BaSO4计算,必然引起负误差。如果沉淀吸附的是挥发性的盐类,灼烧后能完全除去,则将不引起误差。
参考资料:分析化学







