金属离子指示剂的作用
发布时间:2017-09-01
金属指示剂是一些有机配位剂,可与金属离子生成有色配合物,其有色配合物的颜色与游离指示剂的颜色不同,从而可以用来指示滴定过程中金属离子浓度的变化情况,因而称为金属离子指示剂,简称金属指示剂。以铬黑T(EBT)为例说明金属指示剂的作用原理。
铬黑T在pH 8~11时呈现蓝色,它与Ca2+、Mg2+、Zn2+等金属离子形成的配合物呈酒红色。EDTA滴定这些金属离子时,加入铬黑T指示剂,滴定前它与少量金属离子形成酒红色配合物,而大多数金属离子处于游离状态。随着EDTA的不断滴入,游离金属离子逐步被配位形成配合物M-EDTA。当游离的金属离子几乎完全配位后,继续滴加EDTA时,由于EDTA与金属离子形成的配合物(M-EDTA)的条件稳定常数大于铬黑T与金属离子形成的配合物(M-铬黑T)的条件稳定常数,因此,EDTA夺取M-铬黑T中的金属离子,从而将指示剂释放出来,溶液显示出游离铬黑T的蓝色,指示滴定终点的到达。其反应方程式如下:
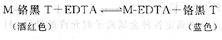
金属离子指示剂应具备的条件。从以上的讨论可知,作为金属指示剂应具备以下条件:
①在滴定的pH范围内,指示剂与金属离子形成的配合物的颜色必须与指示剂本身的颜色有明显的差别。
②指示剂与金属离子形成的配合物的稳定性要适当。它既要有一定的稳定性,但是又要比金属离子与EDTA形成的配合物的稳定性要小。如果指示剂与金属离子形成的配合物的稳定性太低,就会导致终点提前,而且变色不敏锐;相反,如果稳定性太高,又会使终点拖后,而且有可能虽加入过量的EDTA也不能夺走其中的金属离子,得不到滴定终点,这种现象称为指示剂的封闭。通常可采用加入适当的掩蔽剂来消除指示剂的封闭现象。例如,
在pH=10,以EBT为指示剂滴定Ca2+、Mg2+总量时,A13+、Fe3+、Cu3+、Ni2+、Co2+会封闭指示剂,使终点无法确定。可以加入掩蔽剂,使这些干扰离子生成更稳定的配合物,从而不再与指示剂作用,如加入三乙醇胺消除Al抖、Fe。+对EBT的封闭,加入KCN掩蔽Cu2+、Ni2+、C02+。
③指示剂与金属离子的反应必须迅速、灵敏,具有良好的可逆性。
④指示剂与金属离子形成的配合物应易溶于水。如果指示剂与金属离子形成的配合物溶解度很小,将使EDTA与指示剂的置换速率缓慢,终点拉长,这种现象称为指示剂的僵化。解决的方法是可以加入有机溶剂或加热,以增大其溶解度。例如,用PAN作指示剂时常加入乙醇或加热。
由于金属指示剂大多数是具有若干双键的有色化合物,易受日光、氧化剂、空气等的作用而分解,有些在水中不稳定,有些日久则变质。因此,这些指示剂可以用中性盐稀释后配成固体指示剂使用,可在指示剂溶液中加入可以防止变质的试剂。如铬黑T常用氯化钠固体作稀释剂配制。一般金属指示剂都不宜久放,最好用时现配。
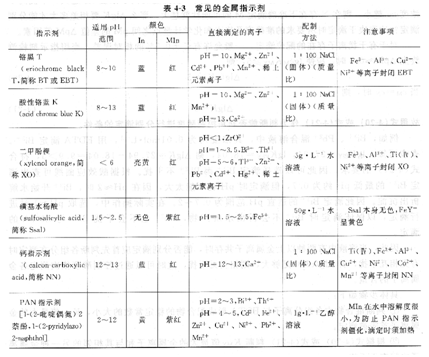
2、常用的金属离子指示剂
常用的金属指示剂列于表4-3。
参考资料:分析化学







