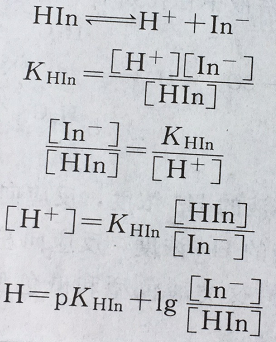酸碱滴定酸碱指示剂
发布时间:2017-09-01
酸碱滴定分析中判断终点的方法主要有两种:指示剂法和电位滴定法。指示剂法是利用指示剂在一定条件时变色来指示终点;电位滴定法则是通过测量两个电极的电位差,根据电位差的突变来确定终点。
这里仅讨论指示剂法。
酸碱指示剂的作用原理:
酸碱指示剂一般为弱的有机酸或有机碱,它们的共轭酸碱对具有不同的结构,因而呈现不同的颜色。当溶液pH值改变时,指示剂失去质子由酸型转变为碱型,或得到质子由碱型转变为酸型,结构发生变化,从而引起颜色的变化。下面以甲基橙和酚酞为例来说明。
甲基橙是一种弱的有机碱,在溶液中存在如下平衡:
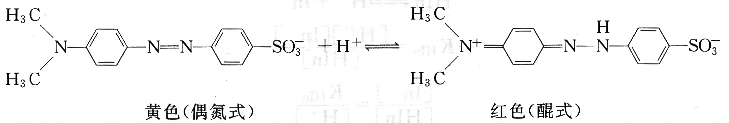
由平衡关系可以看出,增大溶液的H+浓度,反应向右进行,甲基橙主要以醌式(酸色型)存在,溶液呈红色;降低溶液的H+浓度,反应向左进行,甲基橙主要以偶氮式(碱色型)存在,溶液呈黄色。像甲基橙这类酸色型和碱色型均有颜色的指示剂,称为双色指示剂。
又如酚酞,它是一种弱的有机酸,属单色指示剂,在溶液中有如下平衡:
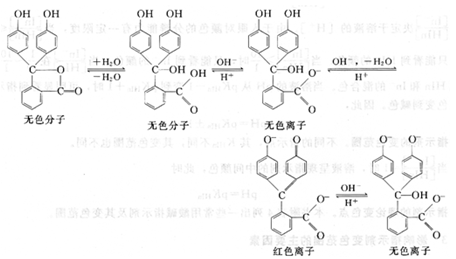
酚酞为无色二元弱酸,当溶液的pH逐渐升高时,酚酞给出一个质子H+,形成无色的离子;然后再给出第二个质子H+并发生结构的改变,成为具有共轭体系醌式结构,呈红色,第二步离解过程的pKa2=9.1。当碱性进一步加强时,醌式结构转变为无色羧酸盐式离子。酚酞结构变化的过程也可简单表示为:
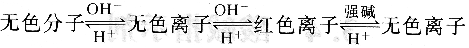
上式表明,这个转变过程是可逆的。当溶液pH降低(H+浓度增大)时,平衡向左移动,酚酞又变成无色的分子。当pH值升高到一定数值后成红色,在浓的强碱溶液中酚酞又变成无色。反之亦然。
指示剂的变色范围
指示剂在不同pH值的溶液中,显示不同的颜色。但是否溶液pH稍有改变时,我们就能看到它的颜色变化呢?事实并不是这样,必须使溶液的pH值改变到一定程度,才能看得出指示剂的颜色变化。也就是说,引起指示剂变色的pH值是有一定范围的,只有在超过这个范围我们才能明显地观察到指示剂颜色的变化。
若以HIn表示一种弱酸型指示剂,In-为其共轭碱,在溶液中有如下平衡: