首页>技术中心>技术资讯>沉淀滴定法概述及银量法确定终点的方法
沉淀滴定法概述及银量法确定终点的方法
发布时间:2017-09-01
以沉淀反应为基础的一种滴定分析法称为沉淀滴定法。沉淀反应虽然很多,但能用于沉淀滴定的反应必须满足下列条件:
①生成沉淀的溶解度必须要小,并且反应能定量进行。
②反应速率要快。
③能够用适当的指示剂或其他方法确定滴定的终点。
④沉淀的吸附现象应不妨碍化学计量点的确定。
由于上述条件的限制,所以能够用于沉淀滴定法的反应很少。目前应用较多的是生成难溶银盐的沉淀反应。例如:
Ag++C1一=AgCl↓
Ag++SCN一=AgSCN↓
利用生成难溶银盐的沉淀滴定法,称为银量法。银量法主要用于测定Cl-、Br-、I-、Ag+及SCN-等。
在沉淀滴定法中,除了银量法外,还有利用其他沉淀反应的方法。例如,K4[Fe(CN)6]与Zn2+,四苯硼钠ENaB(C6H5)4]与K+等形成沉淀的反应,都可以用于沉淀滴定。
2K4[Fe(CN)6]+3Zn2+=K2Zn3[Fe(CN)6]2+6K+
NaB(C6H5)4+K+=KB(C6H5)4↓+Na+
银量法确定终点的方法
沉淀滴定法可以用指示剂确定终点,根据确定终点所用指示剂的不同,银量法可分为莫尔法、佛尔哈德法以及法扬司法。
莫尔法用铬酸钾作指示剂的银量法称为莫尔法。
存含右C1-的中件溶液中。加入K2Cr04指示剂,用AgNO3标准溶液滴定。由于AgCl的溶解度比Ag2CrO4小,根据分步沉淀原理,在用AgNO3滴定的过程中,溶液中首先析出AgCl沉淀。当Cl-定量沉淀后,过量一滴的AgN03与CrO2-4生成砖红色的Ag2CrO4沉淀,即为滴定终点。滴定反应和指示剂的反应分别为:
Ag++Cl-⇌AgCl-↓(白色) Ksp=1.8×10-10
2Ag++CrO2-4⇌Ag2Cr04↓(砖红色) Ksp=9.0×10-12
莫尔法中指示剂的用量和溶液的酸度是两个主要问题。
(1)指示剂的用量
用AgN03标准溶液滴定Cl-时,在滴定终点时,应有:
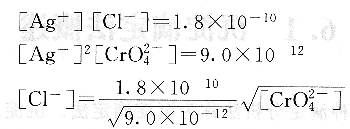
可见,滴定至终点时,溶液中剩余的Cl-浓度的大小与CrO2-4的浓度有关。若CrO2-4的浓度过大,则终点提前到达,溶液中剩余的Cl-浓度就大,从而使测定结果产生较大的负误差。若CrO2-4的浓度过小,则终点推迟,消耗的Ag+又会增多,从而使测定结果产生较大的正误差。因此为了获得准确的测定结果,则必须严格控制CrO2-4的浓度。
反应到达化学计量点时:
![]()
此时所需的CrO2-4浓度为:
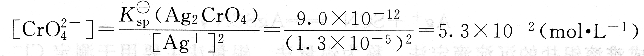
具体测定时,由于K2CrO4显黄色,当浓度较高时颜色较深会影响终点的观察,引入误差,因此指示剂的浓度略低一些为好。一般滴定溶液中CrO2-4浓度约为5.0×10-3mol・L-1,较合适。
(2)溶液的酸度
滴定溶液应为中性或弱碱性(pH=6.5~10.5)。若溶液为酸性,则CrO2-4与H+发生反应:
2H++2CrO2-4⇌2HCrO-4⇌Cr202-4+H20
若溶液碱性太强,Ag+与OH-发生反应:
2Ag++20H一⇌2AgOH⇌Ag20+H20
因此莫尔法要求溶液的pH值范围为6.5~10.5。当试液中有铵盐时,要求溶液的酸度范围更窄,pH为6.5~7.2,因为当溶液的pH值更高时,便有相当数量的NH3释出,形成[Ag(NH3)2]+,使AgCl及Ag2Cr04溶解度增大,影响定量滴定。
凡能与Ag+生成沉淀的阴离子如PO3-4、AsO3-4、SO2-3、S2-、CO2-3、C2O2-4等,以及与CrO2-4一生成沉淀的阳离子,如Ba2+、Pb2+等,还有在中性或弱碱性溶液中易发生水解反应的离子如Fe3+、Al3+、Sn4+、Bi3+等,均干扰测定,应预先将其分离。
由于生成的AgCl沉淀易吸附溶液中的Cl-,使溶液中的C1一浓度降低,以致终点提前而引入误差。因此,测定时必须剧烈摇动,使被吸附的C1-释出。测定Br-时,AgBr吸附Br一比AgCl吸附Cl-严重,测定时更要注意剧烈摇动,否则会引入较大的误差。
莫尔法不适宜测定I一和SCN一,因为AgI和AgSCN沉淀会更强烈地吸附-I和SCN一。此法也不能用于以NaCl标准溶液直接滴定Ag+。这是因为在Ag+试液中加入K2Cr04指示剂,将立即生成大量的Ag2Cr04沉淀,而且Ag2Cr04沉淀转变为AgCl沉淀的速率甚慢,使测定无法进行。
佛尔哈德法
佛尔哈德法是以铁铵矾[NH4Fe(SO4)2・12H20]作指示剂的银量法,包括直接滴定法和返滴定法。
(1)直接滴定法测定Ag+
在含有Ag+的酸性溶液中,以铁铵矾作指示剂,用NH4SCN(或KSCN)标准溶液滴定。溶液中首先析出AgSCN沉淀,当Ag+定量沉淀后,过量的SCN一与Fe3+生成红色配合物,即为终点。滴定反应和指示剂反应如下:
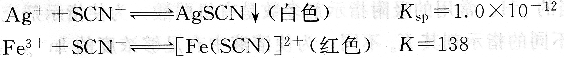
滴定时,溶液的酸度一般控制在0.1~lmol・L一1之间。酸度过低,Fe3+易水解。Fe3+浓度过大,它的黄色干扰终点的观察。综合这两方面的因素,终点时Fe3+浓度一般控制在0.015mol・L-1。
在滴定过程中,不断有AgSCN沉淀生成,由于它有较强烈的吸附作用,所以有部分Ag+被吸附于其表面,因此往往产生终点出现过早的情况,使结果偏低。滴定时,必须充分摇动溶液,使被吸附的Ag+及时地释放出来。
(2)返滴定法测定卤素离子
在含有卤素离子的试液中,首先加入一定量过量的AgN03标准溶液,使之与卤素离子充分反应,然后以铁铵矾为指示剂,用NH4SCN标准溶液返滴定过量的AgN03。
用返滴定法测定C1-时,由于AgCl的溶解度比AgSCN大,故终点后,稍过量的SCN一将与AgCl发生沉淀转化反应,使AgCl转化为溶解度更小的AgSCN:
AgCI+SCN一⇌AgSCN↓+Cl一
所以溶液中出现了红色之后,随着不断地摇动溶液,红色又逐渐消失,不仅多消耗一部分NH4SCN标准溶液,同时也使终点不易判断。为了避免上述误差,通常采取下列措施:
①将溶液煮沸,使AgCl沉淀凝聚,经过滤后用NH4 SCN标准溶液返滴定滤液中过量的AgN03。
②在Cl一溶液中加入过量的AgN03,充分反应后加入有机溶剂如硝基苯或1,2-二氯乙烷1~2mL,以包裹沉淀,可阻止转化反应发生。此法简便,但因硝基苯有毒性,操作时应多加小心。
用返滴定法测定Br一、I一时,由于AgBr及AgI的溶解度均比AgSCN小,不发生上述的转化反应。但在测定I-时,指示剂必须在加入过量的AgN03后加入,否则Fe3+将氧化I-为I2,影响分析结果的准确度。
佛尔哈德法的最大优点是滴定在酸性介质中进行,一般酸度大于0.3tool・L-1。在此酸度下,许多酸根离子如PO3-4、AsO3-4、Cr2 O2-7、C2 O2-4、CO2-3等不干扰滴定;但一些强氧化剂、氮的低价氧化物以及铜盐、汞盐等能与SCN-反应,干扰测定,必须预先除去。
法扬司法
用吸附指示剂确定终点的银量法,称为法扬司法。吸附指示剂是一类有色的有机化合物,当它被吸附在胶体微粒表面之后,可能是由于形成某种化合物而导致指示剂分子结构的变化,因而引起颜色的变化。
例如荧光黄指示剂,它是一种有机弱酸,用HFI表示,在溶液中可解离为阴离子FI一,呈黄绿色。当用AgN03标准溶液滴定CI-时,加入荧光黄指示剂,在化学计量点之前,溶液中Cl-过量,AgCl沉淀表面胶体微粒吸附Cl-而带负电荷(AgCl.C1-),不吸附指示剂阴离子FI-,溶液呈黄绿色。滴定到化学计量点之后,稍过量的AgN03可使AgCl沉淀表面胶体微粒吸附Ag+而带正电荷(Agc卜Ag+)。这时,带正电荷的胶体微粒吸附FI-,形成表面化合物(AgCl・Ag+・FI一),使整个溶液由黄绿色变成淡红色,以指示终点的到达。
为使终点时指示剂颜色变化明显,使用吸附指示剂应注意以下几点:
①控制适当的pH。常用的吸附指示剂多数是有机弱酸,为使指示剂充分解离,必须控制适当的pH。不同的指示剂其Ka不同,为使溶液中有足够浓度的In一,应使溶液的pH>pKa,但过高的pH会使Ag+形成Ag20沉淀,因此须控制适当的pH范围。
②增大沉淀的表面积。吸附指示剂的变色反应发生在沉淀表面,表面积越大,终点时颜色变化越明显,为此可加入糊精、淀粉等胶体保护剂,使沉淀保持胶体状态,以增大沉淀的表面积。
③应避免阳光直接照射,否则滴定过程中卤化银会分解。
④沉淀时胶体微粒对指示剂的吸附能力应稍低于对被测离子的吸附能力,否则化学计量点之前,指示剂离子就进入吸附层使终点提前。卤化银对几种常用吸附指示剂和卤素离子的吸附能力顺序为:
I->SCN>Br一>曙红>C1一>荧光黄
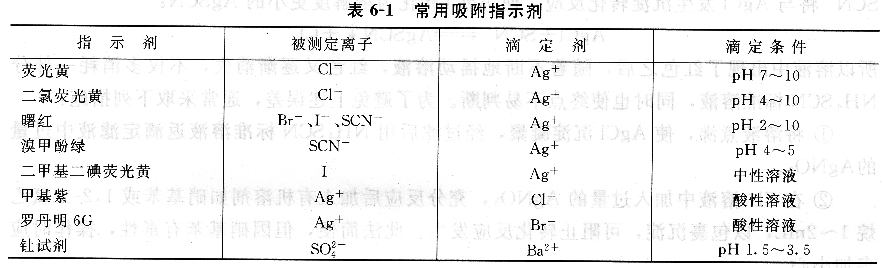
常用吸附指示剂见.表6―1。
参考资料:分析化学







