电分析化学法仪器结构与原理(三)
发布时间:2017-09-01
六、氧化还原电位滴定法测定Fe2+含量
1、实验目的
学习氧化还原电位滴定法的原理与方法。
2、实验原理
用Ce4+滴定Fe2+,反应如下:
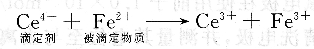
在化学计量点以前电极电位由Fe3+/Fe2+电对来确定,在化学计量点后电极电位由Ce4+/Ce3+电对确定。在化学计量点,电位由两体系的标准电极电位的平均值确定:
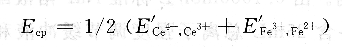

3、仪器与试剂
仪器:带微处理器的离子计,铂电极,双液接甘汞电极,电磁搅拌器。
试剂:O.1000mol/L硫酸亚铁标准溶液:称取39.212g基准试FeSO4・(NH4)2SO4・6H2O,加浓H2SO4和H2O溶解并稀释至1L,H2 SO4浓度约1mol/L。
0.1mol/L Ce4+标准溶液:溶解分析纯Ce(S04)2・2(NH4)2S04・2H20约63g,加H2S04和H2O溶解并稀释至1L,含H2SO4约1mol/L。
4、实验内容与步骤
(1)Ce4+标准溶液的标定
移取10.OOmL FeSO4标准溶液,加20mL浓度为1mol/L的H2SO4,插入铂电极和饱和甘汞电极,放人磁搅拌子搅拌。从滴定管滴加O.1mol/L Ce4+标准溶液,远离化学计量点时,每滴入1.00mL记录一次读数;在化学计量点附近,每滴加O.05mL记录一次读数,至少滴人2倍化学计量的Ce4+以Ce4+滴加体积对电位读数作图,得滴定曲线,求化学计量点对应的Ce4+体积。
(2)含Fe2+试液中Fe2+含量的测定
移取10.OOmL含Fe2+试液,与上述步骤相同,以Ce4+标准溶液滴定。平行测定3次。
5、注意事项
滴定液加入速度不宜过快,尤其是接近化学计量点处,否则体积不准。
6、数据处理
(1)计算Ce4+标准溶液的浓度,并计算试液中Fe2+含量。
(2)报告平均值及标准偏差。
七、络合电位滴定法连续测定溶液中Bi计,Pb抖,Ca+。
1、实验目的
学习以汞电极为指示电极进行络合滴定的方法以及连续测定样品中不同物质的原理与方法。
2、实验原理
若溶液中同时含有几种离子M1,M2和M1,它们都能和EDTA形成络合物,且Kmiy>KM2Y>KM3Y。当用EDTA滴定时,M1首先被滴定。这时M1能否被准确滴定,取决于溶液中M2和M3是否干扰M1的滴定。干扰主要来自M2,选择适当的pH值,在:
![]()
条件下可准确滴定M1而M2不干扰。式中,cM1为在化学计量点时M1的浓度;CM2为在化学计量点时M2的浓度;lgKM1Y,lgKM2Y分别为金属离子M1和M2与EDTA的络合形成常数的对数。LgKMIY为M1与EDTA的条件络合常数的对数。
Bi3+,Pb2+和Ca2+与EDTA的络合稳定常数分别为28.2,18.O和10.7。当Bi3+,Pb2+,Ca2+的浓度都为0.0nnol/L时,一次取样可连续地滴定各自的含量,用电位滴定法可解决无合适指示剂的困难。将溶液的pH值调节至1.2,用Hg电极作为指示电极,饱和甘汞电极为参考电极,此时可准确滴定Bi3+而Pb2+和Ca2+不干扰。当Bi3+滴定至终点,将溶液pH值调节至4.O,再滴定Pb2+,这时Br3+已经络合为BiY不干扰Pb2+的滴定,Ca2+的存在满足式(8.13)也不干扰Pb2+的滴定。当Pb2+滴定至终点后,再将溶液的pH值调节至8.O滴定Ca2+,因而可连续测定样品中3种离子的浓度。
3、仪器与试剂
仪器:带微处理器的离子计,汞电极,双液接参考电极,25mL滴定管,20mL和25mL移液管,l(OOmL烧杯,电磁搅拌器。
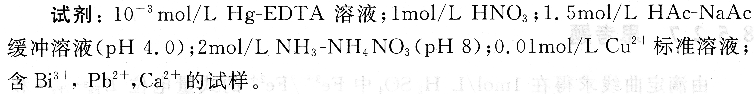
4、实验内容与步骤
(1)EDTA溶液的配置及标定:称取分析纯乙二胺四乙酸二钠盐(Na2C10H14N2 08・2H2O,EDTA)3.28g溶于适量水中,定容至1 L,摇匀。浓度约0.01mol/L。移取20.OOmL Cu2+标准溶液于100mL烧杯中,加入5.OOmLHac-NaAc缓冲溶液和3滴0.001mol/L Hg-EDTA溶液。插入汞电极与参考电极,将离子计置于mV档,在搅拌下记录离子计读数。用O.01mol/L EDTA溶液滴定,开始时每加入1.OOmL溶液记录一次电位值,当接近终点时,每加0.05mL溶液记录一次读数。用作图法求出滴定终点时EDTA体积,计算EDTA标准溶液的浓度。
(2)试样中Bi3+的含量测定:往100mL烧杯中移取含Bi3+,Pb2+,Ca2+试样10.00mL,水20 mL,加0.001mol/L Hg-EDTA溶液3滴,加2.5 mL lmol/LHNO3。溶液pH值大约为1.2,若相差较大则需事先调节试样酸度。插入汞电极与参考电极,置离子计于mV挡。在搅拌下用0.01mol/L EDTA标准溶液滴定,开始时每加1.OOmL标准溶液记录一次电位值,接近终点时每加0.05mL标准溶液记录一次。用作图法求出终点时EDTA体积V1。
(3)pb2+含量的测定:向溶液中加入5.0mL HAc―NaAc缓冲溶液,使溶液pH值为4.0。此时滴定管中EDTA溶液也无需调至0.00mL,继续由EDTA滴定,并记录滴定过程中的mV数。根据滴定曲线求得终点时的EDTA的总体积V2。
(4)Ca2+含量的测定:再向溶液中加入5.0mL NH3―NH4NO3,使溶液pH值为8.0。用EDTA溶液继续滴定至终点,记录滴定过程的电位值,根据滴定曲线求得所消耗EDTA总体积V2。
(5)重复3次上述滴定过程。
(6)实验完成后,洗净烧杯和电极,回收含Pb2+废液。清洗滴定管,将汞电极泡在去离子水中,参考电极收入电极盒中。
5、注意事项
Pb2+与C1一生成沉淀,因此需使用带有硝酸钾盐桥的双液接参考电极,其外室中充5mol/L KNO3作为盐桥。
6、数据处理
由EDTA体积V1计算Bi2+的含量;从体积V2中减去V1,即得到滴定Pb2+时消耗的EDTA体积,计算溶液中的Pb2+含量;从体积V2中减去滴定Bi3+和Ph2+的EDTA总体积V2可计算滴定Ca2+所消耗的EDTA体积,计算样品中Ca2+浓度。由3次滴定的结果报告样品中Bi2+,Pb2+,Ca2+的含量的平均值及标准偏差。
八、自动电位滴定法测定水中Cl一和I一的含量
1、实验目的
学习用自动电位滴定法测定物质浓度的方法。
2、实验原理
用银离子的溶液作滴定剂的电位滴定法广泛应用于卤素离子的测定,可一次取样连续测定Cl-,Br-,I-的含量。除卤素外,它还可用于测定氰化物、硫化物、磷酸盐、砷酸盐、硫氰酸盐和硫醇等化合物的含量。
用AgNO3溶液滴定含有Cl一,Br-,I一的混合溶液时,由于AgI的溶度积小于AgBr,所以AgI首先沉淀。滴入AgNO2溶液时,溶液中[I-]不断降低,[Ag+]不断增加,当[Ag+一]达到使[Ag+][Br]≥Ksp(Agbr)时,AgBr开始沉淀。
如果溶液中[Br-]不是很大,则AgI几乎沉淀完全时AgBr才开始沉淀。同样,当溶液中[C1-]不是很大时,AgBr几乎沉淀完全,AgCl才开始沉淀。这样即可在一次取样中连续分别测定I-,Br-,Cl的含量。若I一,Br一,Cl一的浓度均为O.1mol/L,理论上各离子的测定误差优于O.5%。然而在实际滴定中,当进行Br-与Cl-混合物滴定时,AgBr沉淀往往引起AgCl共沉淀,所以Br的测定值偏高而Cl-的测定值偏低。而Cl一和I-或I-和Br-混合物滴定时可获准确结果。
3、仪器与试剂
仪器:自动电位滴定仪,银电极,双液接参考电极,25mL滴定管。
试剂:AgN03标准溶液(0.10OOmol/L);
含Cl一,I-的未知试液。
4、实验内容与步骤
(1)手动滴定求滴定终点电位
接通仪器电源,预热20min。将AgNO3标准溶液装入滴定管,滴定前调节至0.OOmL。于100mL烧杯中移取25.0OmL含Cl-和I-的未知试液,加入10mL去离子水。
插入电极,选择开关置于mV挡,工作开关置于手动位置,打开搅拌,调节速度。按下读数开关,用校正调节按钮将读数指针调至OmV处,待指针稳定后开始滴定。按手动操作按钮,用AgNo。标准溶液进行滴定。每加2.OOmL,记录一次电位值。当接近两个突跃点时,每加O.05mL记录一次电位值。将电位E对AgNO2滴加体积V作图画滴定曲线,并求出两个终点电位E1和E2值。
(2)自动滴定测Cl-和I-含量
将选择开关置终点,接通读数开关,将预定终点设定调节至第一终点电位E1处,再将选择开关置mV挡位置。指针应在0mV处,工作开关置滴定位置,滴液开关置一位置。打开搅拌,按滴定开始按钮,自动滴定开始。待滴定结束,读取AgNO3溶液消耗体积V1。
将预定终点设定调节至第二个终点电位E2处,继续滴定至第二个终点,读取AgNO3消耗的体积V2。重复上述操作3次。
5、注意事项
银电极表面易氧化而使性能下降,用细砂纸打磨,露出光滑新鲜表面可恢复活性。
6、数据处理
由AgNO3溶液消耗体积V1计算未知液中I-的含量;由Vz计算未知液中Cl-的含量(mg/L)。计算I-和Cl-的含量的平均值与标准偏差。
参考资料:现代仪器分析实验与技术







