电分析化学法仪器结构与原理(二)
发布时间:2017-09-01
三、实验技术
1、电位分析实验技术
直接电位分析法可用标准曲线法和标准加入法。标准曲线法是在同样的条件下由标准物质配制一系列不同浓度的标准溶液,由其浓度的对数与电位值作图求得校准曲线,再在相同条件下测定试样溶液的电位值,由校准曲线上读取试样中待测离子含量。校准曲线法的缺点是当试样组成复杂时,难以保证其组成与校准曲线的条件完全一致,因而有时需要由加人回收实验对方法的准确性加以验证。标准加入法是将一定体积和浓度的标准溶液加入到已知体积的试样中,根据加入前后电位变化计算试液中待测离子浓度。标准加入法的优点是标准溶液和待测溶液中的被测离子是在非常接近的条件下测定的,因而测定结果更加可靠。利用惰性金属如铂电极作指示电极,用饱和甘汞电极作参考电极,可指示体系滴定过程中的氧化还原电极电位的变化。在化学计量点附近产生电位突跃而指示到达终点。
2、电解分析实验技术
在库仑滴定中电解电流是恒定的,因此只要准确测定滴定开始至终点所需要的时间,就可准确测定被滴定物的量。准确地指示滴定终点是非常重要的,指示终点的方法有化学指示剂法、电位法、双铂电极法等。双铂电极法又称永停法,其在碘库仑滴定法中指示终点的原理为:在两铂片电极之间加10~200mV的小电压,在滴定终点之前,电解产生的I2全部与AsO3-3反应,溶液中仅有极少量I2存在,而AsO3-3和AsO3-4大量存在。因而溶液电极电位主要由电对AsO3-3/AsO3-4确定,但AsO3+4+2e=AsO3-3电对为不可逆电对,两个电极间加小电压不能产生电流。相反,电对I2+2e=2I一为可逆电对,当滴定到达终点时,一旦溶液中有略过量的I2出现,立即在电路中产生一电解电流。因此一旦指示电路中出现电流,表明终点到达。
四、极谱和伏安分析实验技术
1、悬汞电极和汞膜电极制备
悬汞电极使用方便,在商品的滴汞电极的汞流路上装有电磁阀,可自动产生大、中、小3种不同体积的悬汞滴。使用挤压式悬汞电极时,旋转千分尺推动顶针挤压储汞器中的汞,使汞从与储汞器相连的毛细管流出形成汞滴,汞滴的大小由千分尺旋转的刻度控制。挂汞式悬汞电极是将直径为0.1mm的铂丝、金丝或银丝封在一适当直径的玻璃管的一端,露出部分的长度约O.1mm,另一端用汞接触的方法引出导线。将此电极浸人饱和硝酸亚汞的硝酸溶液中(0.2~0.5mol/L),在25~30mA的电流下电解1~3min,使汞沉积在铂丝上,可制得直径为1.O~1.5mm的悬汞滴。或将上述制得的电极外端磨平,除去表面的氧化膜,电解镀上一层汞,然后挂上一定大小的汞滴,即成为挂汞式悬汞电极。
在固体电极如玻碳、银或铂电极表面镀上一层薄的汞膜,即为汞膜电极。使用较为普遍的为玻碳汞膜电极。在绝缘管的一端封接一玻碳薄片,另一端接出导线。先将其表面在稀的汞盐溶液中电解镀上一层汞膜,然后插入试液中使用,或者在试液中加入少量汞盐,在电解富集过程中与被测物同时在玻碳上析出形成汞膜和汞齐(同位镀汞)。汞膜的厚度可由溶液中汞盐浓度和电解时间来控制。
2、固体电极表面处理
固体电极处理的第一步是进行机械研磨、抛光至镜面程度。通常用于抛光电极的材料有金刚砂、CeO2、ZrO、MgO和a-A12 O3粉及抛光液。抛光时按抛光剂粒度降低的顺序依次进行研磨,对新的电极表面应先经金刚砂纸粗磨和细磨后,再用a-Al2O3粉按照1.O,0.3,O.05μm粒度在平板玻璃或抛光布上分别进行抛光。每次抛光后先洗去表面污物,再移入超声水浴中清洗,每次2~3min,重复3次。最后用乙醇、稀酸和水彻底洗涤,得到一个平滑光洁、新鲜的电极表面。
固体电极经抛光后接着进行化学的或电化学的处理,尤其电化学处理,是最常用的清洁、活化电极表面的手段。电化学处理常用强酸或中性电解质溶液,有时也用具有弱的络合性的缓冲溶液在恒电位、恒电流或循环电位扫描下极化,根据扫描电位终止的电位不同,可获得氧化的、还原的或干净的电极表面。电化学处理方法还能在试液中直接进行电极处理,方法简单易行。
3、除氧
电解液中溶解的微量O2在室温下可达8mg/L。在极谱分析时,O2也在汞电极上还原,产生两个极谱波:
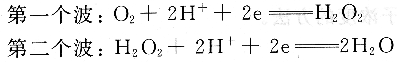
第一个氧波的半波电位约为一0.2V,第二个氧波的半波电位约为一O.8V,均为不可逆的宽带波,干扰测定。因此电化学实验前试液必须除氧,方法是向溶液中通高纯氮l~2min。精确测量时为了不影响试液的浓度,氮气要用溶剂蒸气进行预饱和。测试过程中停止通氮气,但试液要保持在氮气氛围中。
在中性或碱性溶液中也可通过加亚硫酸钠除氧,使氧与之反应生成sO2-4:
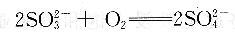
4、超痕量分析的试剂纯化
在极谱和伏安分析时降低或消除杂质的影响是获得高准确度结果的重要条件。要消除残余电流需选用高纯度水及试剂作底液,如仍不满足,通过控制电位汞阴极电解法可除去底液中存在的可还原杂质,浓度可低至O.1μg/L以下。汞的纯度也影响残余电流,特别是阳极溶出分析。汞可用洗涤法或蒸馏法提纯。但汞是易挥发的有毒物质,蒸馏汞时应在密封容器中进行,并在通风良好的场所进行。
5、极谱极大的消除
极谱极大是极谱分析中常见的一种现象。电解开始时,电流随电压的增加迅速增加,达到一个极大值,然后再下降至扩散电流的数值。这种在扩散电流之前出现的峰值电流比扩散电流大许多,干扰极谱的正常分析,称为“极谱极大”现象。这是因为在极谱过程中,汞滴上部由于被毛细管末端所遮蔽,可还原离子不易接近汞表面,因而电流密度较小;而汞滴下部可还原离子可以无阻碍接近汞滴,因而电流密度较大。电流密度不均匀,导致滴汞表面附近的表面张力不一样,从而导致汞滴表面溶液的切向运动,可还原离子便因搅动而更快地达到电极表面,使极谱波产生极大现象。向溶液中加入微量的表面活性物质,例如,用量不超过溶液的O.1%的动物胶、Triton X-100、甲基红等,便可消除极谱极大现象。
五、实验
1、氟离子选择性电极测定水中氟离子含量
(1)实验目的
学习用直接电位法测定氟离子浓度的方法。
(2)实验原理
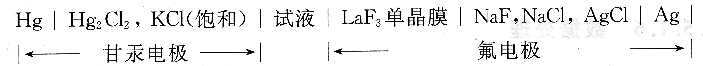
在离子强度和pH值不变时,整个电池的电动势为:
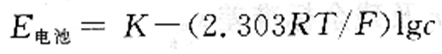
由上式可见,电池电动势与试液中的氟离子浓度的对数呈线性关系。
本实验采用标准曲线法进行定量。
(3)仪器与试剂
仪器:带微处理器的离子计、氟离子选择电极、单液接参考电极、电磁搅拌器。
试剂:NaF标准溶液:0.1000mol/L;
总离子强度调节缓冲溶液(TISAB):溶解58.8g柠檬酸钠和20.2g KNO3于少量水中,加800mL水,以HCl或NaOH调节pH值至6.5,稀释至1L;1.0×10-31mol/L NaF溶液。
2、实验内容与步骤
(1)氟电极准备。氟电极在使用前于1.0×10-3mol/L NaF溶液中浸泡活化1~2h。用去离子水清洗电极,并测量其电位至与去离子水中的电位值相接近(约一300mV)。
(2)预热仪器约20min,接入氟电极与参考电极。
(3)校准曲线绘制。由0.1000mol/L标准NaF溶液配制一系列NaF标准溶液各50mL。其中各含25mL总离子强度调节缓冲液和10-2,10-3,10-4,10-5,10-6 m01/L F一。将上述溶液倒入洗净并干燥的50mL烧杯中,放入磁搅拌子,插入电极。在离子计上按由稀至浓的顺序测定不同F一浓度的电位值,记下读数。测定时搅拌2min,静置lmin,待电位稳定后读数。以测得的毫伏数为纵坐标,以F-浓度的对数为横坐标作校准曲线。
(4)水中氟离子浓度的测定。往烧杯中准确移取25.00mL水样,加25.00mL总离子强度调节缓冲液。用离子计测定电位值,重复3次。
(5)清洗电极。实验结束后,用去离子水清洗电极至电位值与起始空白电位值相近,收入电极盒中保存。
3、注意事项
电极电位在搅拌时和静止时读数不同,测定过程中读数状态应保持一致。
4、数据处理
(1)在校准曲线的线性区间,用最小二乘法进行曲线拟合,计算校准曲线的斜率k、截距b、相关系数r及残余标准差s。
(2)计算未知样中F-浓度的平均值(mol/L)及标准偏差。
参考资料:现代仪器分析实验与技术







