土壤PH值的测定
发布时间:2017-09-01
一、分析意义
土壤酸碱度是土壤重要的基本性质之一,是土壤形成过程和熟化培肥过程的一个指标。土壤酸碱度对土壤中养分存在的形态和有效性,对土壤的理化性质、徽生物活动以及植物生长发育都有很大的影响。
由于大多数作物必需的营养元素的有效性与土壤的pH值有关,在我们掌握足够的土壤科学知识后,是可以根据土壤的pH值相当可靠地评估土壤中养分的有效状况。所以土壤pH值又是估计植物营养元素相对有效性的指标。总的来看,土壤对植物生长所必需的大多数营养元素,于pH6-7范围内有效度最高。例如:土壤中磷酸盐,在pH值小于6.5时,因磷酸铁、磷酸铝的出现而降低其有效性,当pH值大于7.0时,则因形成磷酸钙,植物难以利用。相对而言,土壤pH6.5~7.0时,土壤对磷的固定最少,其对植物的有效性最大。
一般地讲,土壤中的细菌(硝化细菌、固氮菌和纤维分解细菌等)和放线菌,适宜于中性和微碱性环境,在此条件下,其活动旺盛,有机质分解快,固氮作用强,因而土壤有效氮供应较好;而在pH值<5.5强酸性土壤中,其活性急剧下降,此时真菌活动占优势,土壤有效氮供应不足,还可能有NO2一积累。此外,在酸性过强的情况下,植物会因铝、锰的出现而遭毒害;而在强碱性土壤中,由于胶体上交换性钠多,使土粒高度分散,物理性质恶化等等。
我国各类土壤中所含的盐基种类和数量,决定于它们的酸碱性,而各类土壤的酸碱性同特定的生物气候条件、地形、母质来源以及成土过程的长短等均有密切的关系。我国地域辽阔,由南向北pH值逐渐升高。大致以北纬330为界,在其以南地区,因气候温暖湿润,矿物风化和雨水淋溶作用强烈,除部分受母质影响的土壤和石灰性冲积土外,大部分土壤为盐基不饱和,而且纬度愈低,盐基饱和度愈小,如广东、广西、云南和贵州等省红壤和黄壤,盐基饱和度一般在20写-30%,有的甚致小于10%,故地带性土壤呈酸性至强酸性。土壤pH一般在5.0~6.5,低的可小于5.0,如台湾省的新八仙山,海南省的五指山的黄壤pH可低至3.6~3.8。在北纬330以北地区,除东部原始森林植被下发育的土壤的盐基饱和度约60%~80%外,大部分土壤为盐基饱和,而且有一定数量的碳酸钙.如华北、内蒙和西北地区,由于降雨量少而燕发强烈,土壤中的盐分不仅得不到淋洗.反而从下层和地下水中向表土集聚,土壤pH一般在7.5~8.5,高的达10.5。由此可见,我国土壤酸碱度南北差异很大,由南方强酸性土壤到北方的强碱性土壤,按氢离子浓度计算,相差达七个数量级(中国科学院南京土壤研究所,1978)。
二、方法选择的依据
土壤pH值是土壤溶液中氢离子活度的负对数。它是土壤中最重要的一种物理化学性质,可用水处理土壤制成悬浊液进行测定。许多西欧和前苏联学者建议测定土壤在中性盐溶液中的pH,其中最常用的是氯化钾溶液[c(KCI)=1.0 mol・ L-1],我国也有许多实验室用以测定强酸性(pH值<5.5)的土壤。近年来,西欧有些国家测定土壤在抓化钙溶液[c(CaC12)=0.01mol・L-1]中的PH。但土壤在氛化钾溶液或抓化钙溶液中的pH值较在水中者为低,因此,测定结果应注明,当解释结果时,要考虑这种差异。
在测定土壤pH时,选择一个合适的水土比例是非常重要的。水土比例愈大,PH升愈高。国际土壤学会规定水土比为2.5∶1,在我国例行分析中以1∶1,2.5∶1, 5∶1较多,为使测定结果更接近田间的实际情况,水土比以I∶1或2.5∶1甚至饱和泥浆较好,盐土用5∶1。此外,随着坚固的玻瑞电极的出现,对于一般水分含量的田间土壤也有可能进行原位的测定。
土壤pH值的测定可分为电位法和比色法两大类,随着分析仪器的进展,比色法现在仅在田间约测时使用,目前,我国各个土壤分析实验室一般都采用电位法。电位法有准确((0.02pH)、快速、方便等优点。比色法不需要贵重仪器,受测量条件限制较少,便于野外测定,但准确度低((0.5pH),对于要求0.5pH单位准确度的测盆仍是方便可靠的。
二、电位法
1、 方法原理
用pH计测定土壤悬浊液pH时,常用玻璃电极为指示电极,甘汞电极为参比电极。当pH玻璃电极和甘汞电极插入土壤悬浊液时,构成一电池反应,两者之间产生一个电位差,由于参比电极的电位是固定的,因而该电位差的大小决定于试液中的氮离子活度,氢离子活度的负对数即为pH,可在pH计上直接读出pH值。
2、仪器及设备
pH计(注1);玻瑞电极(注2);饱和甘汞电极(注3);或复合电极。
3、试剂
(1) pH4.01标准缓冲溶液;10. 21 g在105℃供过的苯二甲酸氢钾(KHC8H8O8,分析纯),用水溶解后定容至1L。
(2)pH6.87标准缓冲溶液:3.39g在50℃烘过苯二甲酸氢钾(KHC2HO4,分析纯) 和3.53g无水磷酸氢二钠(Na2HPO4,分析纯) ,溶于水后定容至1L。
(3) pH9.18标准缓冲溶液:3.80 g硼砂(Na2B4O7・10H20,分析纯)溶于无二氧化碳的冷水中,定容至1L。此溶液的pH易于变化,应注意保存。
(4)氯化钙溶液〔c(CaCI2・2H20) = 0.01 mol・L-1]:147.02g氯化钙(CaC12・2H2O,化学纯)溶于200 ml,水中,定容至1L,吸取10mL于500ml,烧杯中,加400ml,水,用少量氢氧化钙或盐酸调节pH为6左右,然后定容至1L。
4、操作步骤
(1)待侧液的制备:称取通过2mm筛孔的风干土样10.00g于50mL,高型烧杯中,加入25mL无二氧化碳的水(注4)或氛化钙溶液〔试剂(4),中性、石灰性或碱性土测定用]。用玻璃棒剧烈搅动1 min~2min,静置30 min,此时应避免空气中氨或挥发性酸气体等的影响,然后用pH计测定(注5)
(2)仪器校正:把电极插人与土壤浸提液pH接近的缓冲溶液中,使标准溶液的pH值与仪器标度上的pH值相一致.然后移出电极,用水冲洗、滤纸吸干后插人另一标准缓冲溶液中,检查仪器的读数。最后移出电极、用水冲洗、滤纸吸干后待用。
(3)侧定:把玻璃电极的球泡浸入待测土样的下部悬浊液中,并轻微摇动,然后将饱和甘汞电极插在上部清液中,待读数稳定后,记录待测液pH值。每个样品测完后,立即用水冲洗电极,并用干滤纸将水吸干再侧定下一个样品,在较为精确的测定中,每测定5个~6个样品后,需要将饱和甘汞电极的顶端在饱和抓化钾溶液中浸泡一下,以保持顶端部分为抓化钾溶液所饱和,然后用pH标准缓冲溶液重新校正仪器。
5、结果计算
一般的pH计可直接读出pH值,不需要换算。
6、允许偏差
两次称样平行测定结果的允许差为0.1pH;室内严格掌握测定条件和方法时,精密pH计的允许差可降至0.02 pH。
7、注意事项
(1)pH计的使用参照仪器说明书。
(2)使用玻璃电极注意事项:①干放的电极使用前应在盐酸溶液〔c(HCI)=0.1 mol・L-1〕或水中浸泡12小时以上,使之活化。②使用时应先轻轻震动电极,使其内溶液流人球泡部分,防止气泡的存在。③电极球泡极易破损,使用时必须仔细谨慎,最好加用套管保护。
④电极不用时可保存在水中,如长期不用可放在纸盒内干放。
⑤玻璃电极表面不能沾有油污,忌用浓硫酸或铬酸洗液清洗玻璃电极表面。不能在强喊及含氛化物介质中或粘土等胶体系中停放过久。以免损坏电极或引起电极反应迟纯。
(3)使用饱和甘汞电极注意事项:①电极应随时由电极测口补充饱和氯化钾的内溶液和氯化化钾固体。不用时可以存放在饱和抓化钾溶液中或前端用橡皮套套紧干放。②使用时要将电极测口的小橡皮塞拔下,让氯化钾溶液维持一定的流速。③不要长时间浸在被侧溶液中,以防止流出的氛化钾污染待测液。④不要直接接触能侵蚀汞和甘汞的溶液,如浓度大的S2-溶液。此时应改用双液接的盐桥,在外套管内灌注抓化钾溶液。也可用琼脂盐桥。琼脂盐桥的制备:称取优等琼脂3g和氯化钾(KCI,分析纯)10g,放于150 mL上加热溶解,再用滴管将溶化了的琼脂溶液灌注于直径4mmU形管中,加加水100 mL,在水浴上加热溶解,再用滴管将溶化了的琼脂溶液灌注于直径4mm的U形管中,中间要没有气泡,两端要灌满,然后浸在氯化钾溶液 [c(KCI)=1.0 mol・L-1]中。
(4)如果要侧定酸性土壤(包括潜性酸)的pH值,可用氛化钾溶液[c(KCI)=1.0 mol・L-1〕代替无二氧化碳蒸馏水,其它操作步骤均与水浸提液相同。
(5)测定时注意事项:①土壤不要磨得过细,以通过2mm孔径筛为宜。样品不立即测定时,最好贮存于有磨口的标本瓶中,以免受大气中氨和其他挥发气体的影响。②加水氯化钙后的平衡时间对测得的土壤pH值是有影响的,且随土壤类型而异。平衡快者,1min即达平衡;慢者可长至lh。一般来说,平衡30min是合适的。③ PH玻璃电极插人土壤悬液后应轻微摇动,以除去玻璃表面的水膜,加速平衡,这对缓冲性弱和pH较高的土壤尤为重要。④饱和甘汞电极最好插在上部清液中,以减少由于土壤悬液影响液接电位而造成的误差。
三、比色法
1、 方法原理
指示剂随溶液的pH值而改变颜色。因此,根据混合指示剂与pH4.0~8.0的标准缓冲溶液系列产生的颜色,用各种有色的无机试剂溶液,按不同比例混合成模拟的pH永久色阶的贮存液,标明其pH值(每个间隔为0.2 PH单位),然后在待侧液中加人用本法配侧的混合指示剂,经显色后与其进行目视比色,即可迅速地确定出待侧液的pH值。
2、试剂
(1)pH混合指示剂:0.1 g甲基红盆于玛瑙研钵中,加人少量无水乙醉研磨,配成100 ML乙醉溶液,加7.4 mL氢氧化钠溶液[c(NaOH)=0.050 mol・L-1〕,用水稀释到500ML,另称取0.lg溴百里酚兰,溶于52 mL无水乙醉中,加3.2 mL氢氧化钠溶液[c(NaOH)=0.050Mol・ L-1],用水稀释到250mL。将1份甲墓红溶液和2份澳百里酚兰溶液混合,即为pH混合指示剂。此溶液存放在深色的滴瓶中。
(2)抓化枯溶液:59.5 g氯化钴(CoCI2・6H2O,分析纯)溶于1L盐酸溶液[ψ(HCI)=1%]中。
(3)氯化铁溶液:45.05 g抓化铁(FeC13・6H2O,分析纯)溶于1 L盐胶溶液〔ψHCI)=1%]中。
(4)氯化铜溶液:400g氛化钢(CuCI2・2H2O,分析纯)溶于1L盐酸溶液[ψHCI)=1%]中。
(5)硫酸铜溶液:200 g硫酸钥(CuSO4・5H20,分析纯)溶于1L硫酸溶液〔ψH2SO4)=1%]中。
将上述配好的2至5溶液按表2-1中的比例混合,并加人一定量的水配制成永久色阶。各级溶液分别贮存于平底试管(规格要一致)中,标明pH值,加塞,蜡封保存。
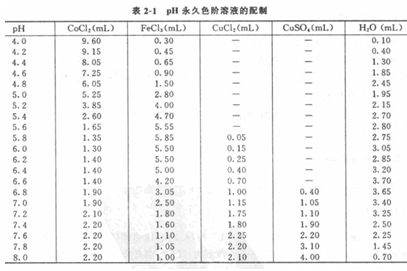
3、操作步骤
取10mL水浸出液(水:土为2.5:1)置于平底试管中(与标准色阶试管同样规格),加人12滴pH棍合指标荆,摇匀后马上与永久色阶进行目视比色,确定其pH值。
4、允许偏差
两次平行测定结果允许偏差为0.5PH。
参考资料:土壤农业化学分析方法







