首页>技术中心>技术资讯>EDTA与金属离子的配位化合物(二)
EDTA与金属离子的配位化合物(二)
发布时间:2017-09-01
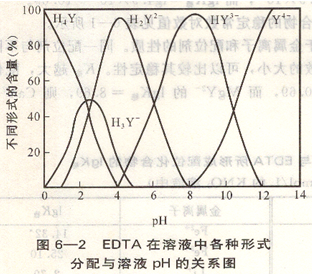
从图6―2可以看出,当pH>12时,EDTA几乎全部是以Y4-形式存在的,只有Y4-才能与金属离子配位,因此, [Y4-]称为有效浓度,用[Y4-]有表示,而[Y]总表示溶液的总浓度,则:
![]()
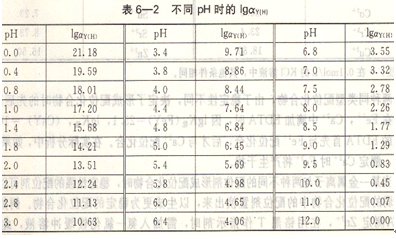
[Y]总与[Y4-]有浓度的比值称配位剂的酸效应系数,用ay(H),表示。
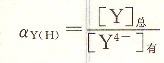
不同pH酸效应系数列于表6―2。
从表中看出ay(H)与溶液酸度有关,随着溶液pH增大而减小,当pH<12时,![]()

当pH>12时,EDTA的有效浓度[Y4-]几乎等于EDTA的总浓度[Y]总。
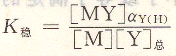
将上式取对数得:
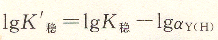
K’稳叫做表观稳定常数(即条件稳定常数),它的大小说明在pH不同时配位化合物的实际稳定程度。
由计算得pH=10时,MgY和PbY都较稳定;而pH=6时,MgY不稳定,PbY仍较稳定。上述说明酸度增大,酸效应系数也增大,配位化合物的表观稳定常数下降。在较大的酸度条件下,[Y4-]有降低,配位化合物的配合能力下降,即对任一配位化合物,酸度越低,配合能力越强,反之则配合能力越弱。不同金属离子和EDTA的配位化合物的稳定性是不同的,配合能力强的可在较高的酸度下配合,配合能力弱的,只能在较低的酸度下配合。这样,可用表观稳定常数来表明EDTA在酸度影响下的实际配合能力,即在一定条件下的实际配合能力。
这里只讨论了酸度对EDTA与金属离子配合稳定性的影响,它是主要的一方面。此外,在滴定分析中,还有金属离子的水解、金属离子与EDTA形成的酸式或碱式的配位化合物以及其他配位化合物所引起的混合物的影响等。
2、酸效应曲线和单一离子滴定可行性判断与pH的选择
表观稳定常数可以表明配位化合反应在具体条件下的完全程度。
如果被测离子的初浓度为[M0],终点时未配合的金属离子浓度为[M],滴定的允许误差为T(一般为0.1%)。则在滴定终点时必须符合下列要求。
(1)被测离子几乎全部被EDTA配合,即[MY]=[M0];
(2)被测离子剩余的浓度应小于或等于滴定的允许误差和起始浓度的乘积,即[M]≤T[M0];
(3)过量EDTA的浓度也应小于或等于滴定允许误差和起始浓度乘积,即[Y4-]≤丁[M0]。
将这三个式子代入式(6―6),即得:
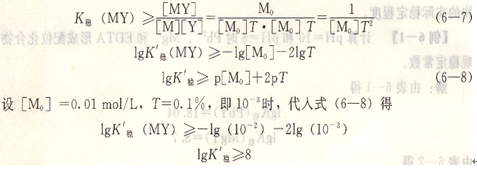
在上述设定条件下,金属离子和EDTA所形成配位化合物的表观稳定常数必须大于或等于8时,配位滴定才能进行。如果滴定条件不同,即T和[M0]变动,则必须用式(6―8)进行计算求得相应的lgK’稳,才能判别配位滴定反应能否符合要求。
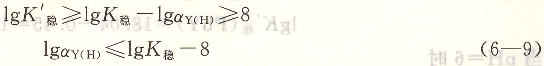
利用式(6―9)可以估算金属离子在上述条件下,用EDTA滴定所允许的最小pH。
参考资料:分析化学







