首页>技术中心>技术资讯>EDTA与金属离子的配位化合物(一)
EDTA与金属离子的配位化合物(一)
发布时间:2017-09-01
一、EDTA与金属离子配合物的特点
1、稳定性强
EDTA和金属离子所形成的配位化合物结构中有5个5原子环,因此配位化合物非常稳定,如,Co2+和EDTA的配位化合物,其结构示意图如图6―1所示。
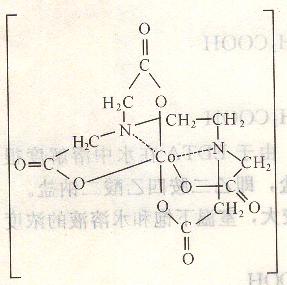
2、配位比简单
EDTA分子中,具有6个可与金属离子形成配位键![]() 同时,还有4个可电离的H+,一般1~4价的金属离子的配位数大多为4或6,当EDTA与金属离子配位时,一个EDTA分子就能满足一个金属离子的配位数和电荷的要求。所以,当EDTA与1~4价的金属离子配位化合时,其配位化合比大多为1∶1,生成的配位化合物可用下列反应表示。
同时,还有4个可电离的H+,一般1~4价的金属离子的配位数大多为4或6,当EDTA与金属离子配位时,一个EDTA分子就能满足一个金属离子的配位数和电荷的要求。所以,当EDTA与1~4价的金属离子配位化合时,其配位化合比大多为1∶1,生成的配位化合物可用下列反应表示。
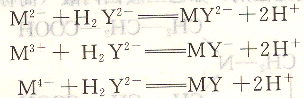
这样在计算中,EDTA与1~4价的金属离子配合时均取其化学式作为基本单元,计算简便。
3、有利于用指示剂确定终点
大多数金属离子与EDTA生成的是无色配位化合物,因此,有利于选择适当指示剂来确定终点。但有色离子与EDTA配位一般生成颜色更深的配位化合物,如:
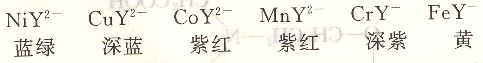
因此,在滴定这些离子时,应尽量使其浓度低些,以免在确定终点时,影响观察。
二、金属离子与EDTA的配位平衡
EDTA与金属离子形成 1:1的配位化合物,在溶液中的离解平衡,可用下式表示(为讨论方便,略去式中的电荷)。

式中:[MY]――M―EDTA配位化合物的浓度,mol/L;
[M]――未配位的金属离子的浓度,mol/L;
[Y]――未配位的EDTA阴离子的浓度,mol/L。
K稳的数值一般较大,为了方便起见,采用lgK稳来表示,如反应:
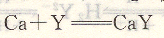
在平衡时,CaY的稳定常数为K稳=4.9×1010,而lgK稳=1g4.9×1010=lO.69。
常见金属离子和EDTA的配位化合物的稳定常数对数值见表6―1所示。
配位化合物的稳定性,主要决定于金属离子和配位剂的性质。同一配位剂与不同离子形成的配位化合物,根据其稳定常数的大小,可以比较其稳定性。K稳越大,配位化合物越稳定,如CaY2-的lgK稳=10.69,而MgY2-的lgK稳=8.69,则CaY2-较MgY2-稳定。
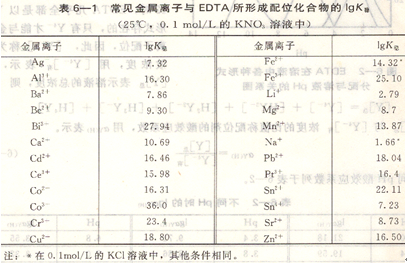
两种同类型配位化合物,由于稳定性不同,决定了形成配位化合物时的先后次序。如在Fe3+,Ca2+中滴加EDTA时,因lgK稳(FeY)=25.1,lgK稳,(CaY)=10.69,加入的EDTA首先与Fe3+配位化合,后才与Ca2+配位化合。在实际分析中,如果Fe3+存在,测定Ca2+时Fe3+将产生干扰。
当某一金属离子与两种不同的配位剂形成配位化合物时,稳定性强的配位剂可以将稳定性弱的配位化合物中的配位剂置换出来,以生成更为稳定的配位化合物。如,用EDTA测定Zn2+,在用铬黑T作指示剂时,需加入氨一氯化铵缓冲溶液,此时有[Zn(NH3)4]2+(1gK稳=8.7)的配位化合物生成。当滴定时,由于EDTA对Zn的配位化合物更为稳定(1gK稳(ZnY)=16.50),故EDTA可以从[Zn(NH3)4]2+中把NH3置换出来。
三、只考虑酸效应时EDTA金属配合物的稳定性
1、EDTA的离解平衡及条件稳定常数
EDTA是一种四元酸,一般用H4Y表示。在水溶液中,具有四级离解平衡关系:
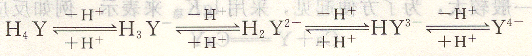
和其他多元酸相似,EDTA在水溶液中共有五种存在形式,即H4Y, H 3 Y一, H 2 Y2-, HY3-,Y4-。在一定的酸度下,各种形式的浓度有一定比例,其分布与溶液pH的关系如图6―2所示。
参考资料:分析化学







