氧化还原滴定法――高锰酸钾法
发布时间:2017-09-01
一、概述
高锰酸钾是一种氧化剂。在强酸性溶液中,KmnO4与还原剂作用时获得5个电子,还原为Mn2+。
![]()
在中性或碱性溶液中获得3个电子,还原为MnO2。
![]()
由此可见,高锰酸钾法既可在酸性条件下使用,也可在中性或碱性条件下使用。由于KmnO4在强酸性溶液中具有更强的氧化能力,生成的Mn2+不干扰终点的观察,因此一般在强酸性溶液中使用。所用的强酸一般为H2sO4,避免使用HCl和HNO3,因为Hcl中Cl-具有还原性,在一定条件下也能与KmnO4作用,而HNO3具有氧化性,它可能氧化某些被滴定的物质。但KmnO4在碱性条件下氧化有机物的反应速度比在酸性条件下更快。在NaOH浓度大于2m01.L-1的碱溶液中,很多有机物与KmnO4反应,此时MnO4-被还原为MnO42+。
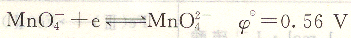
用KmnO4作氧化剂,可直接滴定许多还原性物质,如Fe(Ⅱ)、H2O2、草酸盐、As(Ⅲ)、Sb(Ⅲ)、W(V)、及U(Ⅳ)等。
有些氧化性物质不能用KmnO4溶液直接滴定,可用问接法测定。例如测定MnO2的含量时,可在试样的H2SO4溶液中加入一定过量的Na2C2O4,待MnO2与C2O42-作用完毕后,用KmnO4标准溶滴定过量的C2O42-。利用类似的方法,还可测定PbO2,Pb3O4,K2Cr2O7,KclO3以及H3VO4等氧化剂的含量。
某些物质虽不具氧化还原性,但能与另一还原剂或氧化剂定量反应,也可以用间接法测定。如,测定Ca2+时,先将Ca2+沉淀为CaC2O4,再用稀H2SO4将所得沉淀溶解,然后用KmnO4标准溶液滴定溶液中的C2O42-,从而间接求得Ca2+的含量。显然,凡是能与C2O42-定量地沉淀为草酸盐的金属离子(如Sr2,Ba2+,Ni2+,Cd2+,Zn2+,Cu2+,Pb2+,Hg2+,Ag+,Bi3+,Ce3+,Ce3+,La3+等)都能用同样的方法测定。
高锰酸钾法的优点是KmnO4氧化能力强,应用广泛。但由于其氧化能力强,可以和很多还原性物质发生作用,所以干扰也比较严重。此外,KmnO4试剂常含少量杂质,其标准溶液不够稳定。
二、高锰酸钾标准溶液
市售的高锰酸钾常含有少量的杂质,如硫酸盐、氯化物及硝酸盐等,因此不能用直接法配制准确浓度的标准溶液。KmnO4氧化力强,易和水中的有机物、空气中的尘埃、氨等还原性物质作用。KmnO4还能自行分解,如下式所示:
![]()
分解的速度随溶液的pH而改变,在中性溶液中分解很慢,但Mn2+和MnO2的存在能加速其分解,见光时分解得更快,因此KmnO4溶液的浓度容易改变。
为了配制较稳定的KmnO4溶液,需采用以下方法:
①可称取稍多于理论量的KmnO4固体,溶于一定体积的蒸馏水中。
②加热煮沸,并保持微沸1 h,冷却后贮于棕色瓶中,于暗处放置数天,使溶液中可能存在的还原性物质完全氧化。
③用微孔玻璃漏斗过滤以除去析出的MnO2沉淀,再进行标定。使用久置的KmnO4溶液时应重新标定其浓度。
KmnO4溶液可用还原剂作基准物来标定。H2C2O4・2H2O,Na2C2O4,FeSO4.(NH4)2SO4・6H2O,纯铁丝及As2O3等都可用作基准物。其中草酸钠不含结晶水,容易提纯,是最常用的基准物质。
在H2SO4溶液中,Mn04-与C2O42-的反应为:
![]()
为了使此反应能定量地、较迅速地进行,应注意下述滴定条件。
(1)温度
在小于600C时,此反应的速度缓慢,因此应将溶液加热至75~850C;但温度如超过900C,在酸性溶液中会使部分H2C2O4发生分解。
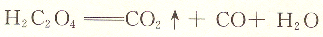
(2)酸度
溶液保持足够的酸度,一般在开始滴定时,溶液的酸度约为0.5~1 m01・L-1,滴定终了时酸度约为0.5 mol・L-1。酸度不够时,往往容易生成MnO2沉淀,酸度过高又会促使H2C2O4分解。
(3)滴定速度
由于Mn04-与C2O42-的反应是自动催化反应,滴定开始时,加入的第一滴KmnO4溶液已起作用后,滴定速度就可以稍快些,但不能让KmnO4溶液来不及与C2O42-反应,即在热的酸性溶液中发生分解。
![]()
(4)KmnO4法滴定终点是不太稳定的,这是由于空气中的还原性气体及尘埃等杂质落入溶液中能使KmnO4缓慢分解,而使粉红色消失,所以经过O.5 min不褪色即可认为终点已到。
(5)应用酸式滴定管,用完及时清洗。
三、应用示例
1、过氧化氢的测足
商品双氧水中的过氧化氢,可用KmnO4标准溶液直接滴定,其反应为:
![]()
该滴定过程可在室温时于硫酸或盐酸介质中顺利进行,但开始时反应进行较慢,反应产生的Mn2+可起催化作用,使以后的反应加快。
H2O2不稳定,在其工业品中一般加入某些有机物如乙酰苯胺等作稳定剂。这些有机物大多能与Mn04-作用而干扰H 202的测定。此时过氧化氢宜采用碘量法或硫酸铈法测定。
2、钙的测定
某些金属离子能与C2042-生成难溶草酸盐沉淀,如果将生成的草酸盐沉淀溶于酸中,然后用KmnO4溶液来滴定C2042-,就可间接测定这些金属离子。钙离子的测定就可采用此法。
在沉淀Ca2+时,为了获得颗粒较大的晶形沉淀,并保证Ca2+=与C2O42-有1∶1的关系,必须选择适当的沉淀条件。通常是在Ca2+试液中先加盐酸酸化,再加入(NH4)2C2O4。由于C2O42-在酸性溶液中大部分以HC2O4-形式存在,C2042-的浓度很小,此时即使Ca2+浓度相度相当大,也不会生成CaC2O4沉淀。向加入(NH4)2C2后的溶液中滴加稀氨水,由于H+逐渐被中和,C2042-浓度缓缓增加,就可以生成粗颗粒结晶的CaC2O4沉淀。最后应控制溶液的pH在3.5~4.5之问(甲基橙显黄色)并继续保温约30 min使沉淀陈化。这样不仅可以避免Ca(OH)2或(CaOH)2C2O4沉淀的生成,而且所得CaC2O4溶于稀硫酸中,即可用KmnO4标准溶液滴定热溶液中与Ca2+定量结合的C2O42-。
3、铁的测定
用KmnO4溶液滴定Fe2+,以测定矿石(例如褐铁矿等)、合金、金属盐类及硅酸盐等试样中的含铁量,有很大的实用价值。
试样溶解后(通常使用盐酸作溶剂)生成的Fe2+(实际上是FeCl4-,FeCl63-等配离子),应先用还原剂使之还原为Fe2+,然后用KMn4标准溶液滴定。常用的还原剂是SnCl2(也有用Zn,A1,H2S,SO2及汞齐等作还原剂的),多余的SnCl2可以借加入HgCl2而除去。

不过,HgCl2有剧毒,为了避免对环境的污染,近年来采用了各种不用汞盐的测定铁的方法。
在以KmnO4溶液滴定前还应加入硫酸锰、硫酸及磷酸的混合液,其作用是:
(1)避免Cl-存在下发生的诱导反应。
(2)由于滴定过程中生成黄色的Fe3+,达到终点时,微过量的KmnO4所呈现的粉色将不易分辨,以致影响终点的正确判断。在溶液中加入磷酸后,PO43-与Fe3+生成无色的Fe(PO4)23-配离子,就可使终点易于观察。
4、有机物的测定
在强碱性溶液中,过量KmnO4能定量地氧化某些有机物。例如KmnO4与甲酸的反应为:
![]()
待反应完成后,将溶液酸化,用还原剂标准溶液(亚铁离子标准溶液)滴定溶液中所有的高价态的锰,使之还原为Mn(Ⅱ),然后计算出消耗的还原剂的物质的量。用同样方法测出反应前一定量碱性KmnO4溶液相当于还原剂的物质的量,根据二者之差即可计算出甲酸的含量。
用此法还可测定葡萄糖、酒石酸、柠檬酸、甲醛等的含量。
5、水样中化学耗氧量(COD)的测定
COD是量度水体受还原性物质污染程度的综合性指标,它是指水体中还原性物质所消耗的氧化剂的量,换算成氧的质量浓度(以mg・L-1计)。测定时在水样中加入H2SO4及一定量过量的KmnO4溶液,置沸水浴中加热使其中的还原性物质氧化。用一定过量的Na2C4O4溶液还原剩余的KmnO4溶液,再以KmnO4的标准溶液返滴定剩余的Na2C2O4溶液。本法适用于地表水、地下水、饮用水和生活污水中COD的测定。反应式为:
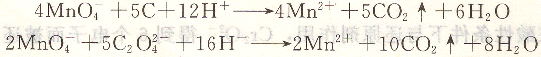
由于C1一对此法有干扰,因此含Cl-高的工业废水中COD的测定应采用K2Cr2O7法。
参考资料:分析化学







