沉淀滴定法――法扬司法
发布时间:2017-09-01
用吸附指示剂指示终点的银量法称为法扬司法。
一、原理
吸附指示剂是在沉淀表面上发生颜色改变的指示剂,它一般是有色的有机弱酸。吸附指示剂不是在溶液中变色,而是由于胶体沉淀表面带正电荷时,指示剂的酸根阴离子被吸附在胶体微粒表面而发生分子结构的变化,从而发生颜色的改变。
如,用AgNO3标准溶液滴定Cl-时,采用荧光黄作指示剂。荧光黄是一种有机弱酸。可用HFIn表示,它的离解如下:
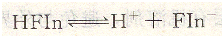
在计量点前,溶液中存在过量的C1一,AgCl沉淀吸附C1-而带负电荷形成AgCl・Cl一,荧光黄的阴离子不被吸附,溶液呈现Fin一的黄绿色。当滴定到计量点时,过量1滴的AgNO3即可使AgCl因吸附Ag+而带正电荷,形成AgCl・Ag+,它强烈的吸附Fin-。荧光黄阴离子被吸附后,结构发生变化,使沉淀表面呈现粉红色,从而指示滴定终点。
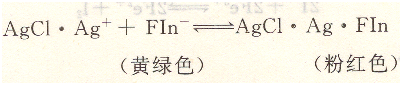
用AgNO3作标准溶液时,常见的几种吸附指示剂的使用条件参见表8―2。

二、滴定条件
(1)由于吸附指示剂是吸附在沉淀表面上而变色的,为了使终点变色更明显,就必须使沉淀有较大的表面积,这就需要把AgCl沉淀保持胶体状态。因此,滴定时一般先加入糊精或淀粉溶液等亲水性的高分子化合物作为胶体保护剂。
(2)滴定必须在中性、弱酸性或弱碱性溶液中进行。这是因为酸度较高时指示剂阴离子浓度小,不易为正电溶胶所吸附。酸度较低时,除了可以形成Ag2O沉淀外,指示剂的电离过强,可能在计量点之前就被吸附,使终点提前。至于合适的酸度范围与指示剂的离解常数的大小有关,离解常数越大,酸性可以强一些,如荧光黄Ka≈10-7,适宜的酸度范围为pH=7~lO,二氯荧光黄Ka≈10-4,适宜的酸度范围为pH=4~10,曙红(四溴荧光黄,Ka≈10-2),适宜的酸度范围为pH=2~10。
(3)因卤化银易感光变黑,影响终点观察,所以应避免在强光下滴定。
(4)被测离子的浓度不能太稀。因为浓度太稀时,生成的沉淀量很少,观察终点比较困难。如以荧光黄作指示剂,用AgNO3标准溶液滴定Cl一时,要求[C1-]>0.005mol/L,但测定Br一,I一和SCN-时,其灵敏度较高,浓度低至0.001mol/L时仍可准确测定。
(5)胶体微粒对指示剂阴离子的吸附能力应略小于对被测离子的吸附能力,否则将在计量点前变色。但其也不能太小,否则使终点推迟。卤化银对卤离子及吸附指示剂的吸附能力的次序为:








