沉淀的类型和沉淀条件的选择
发布时间:2017-09-01
在重量分析中,为了获得准确的分析结果,减少沉淀的溶解损失。为此,应根据沉淀类型,要求的沉淀。
一、晶形沉淀的沉淀条件
要求沉淀完全、纯净、易于过滤和洗涤,并选择不同的沉淀条件,以获得符合重量分析。
(1)沉淀反应应当在稀的溶液中进行这样可使沉淀过程中溶液的相对过饱和度较小,易于获得大颗粒的晶形沉淀。同时,共沉淀现象减少,有利于得到纯净沉淀。当然,如果溶液的浓度太稀,则会由于沉淀溶解损失而超过允许的分析误差。
(2)在不断搅拌下,慢慢地滴加沉淀剂。
这样可避免当沉淀剂加入到试液中时,由于来不及扩散,导致局部相对过饱和度太大,获得颗粒较小、纯度差的沉淀。
(3)沉淀反应应在热溶液中进行。
在热溶液中,沉淀的溶解度增大,溶液的相对过饱和度降低,易获得大的晶粒;另一方面又能减少杂质的吸附,有利于得到纯净的沉淀。为了防止在热溶液中所造成的沉淀溶解损失,对溶解度较大的沉淀,沉淀完毕后必须冷却,再过滤洗涤。
(4)陈化。
陈化是在沉淀完全后,将沉淀和母液一起放置一段时间,这个过程称为“陈化”。当溶液中大小晶体同时存在时,由于微小晶体比大晶体溶解度大,溶液对大晶体已经达到饱和,而对微小晶体尚未达到饱和,因而微小晶体逐渐溶解。溶解到一定程度后,溶液对小晶体为饱和,对大晶体则为过饱和,于是溶液中的构晶离子就在大晶体上沉积。当溶液浓度降低到对大晶体是饱和溶液时,对小晶体已不饱和,小晶体又要继续溶解。这样继续下去,小晶体逐渐消失,大晶体不断长大,最后获得粗大的晶体。
在陈化过程中,还可以使不完整的晶粒转化为较完整的晶粒,亚稳态的沉淀转化为稳定态的沉淀。根据具体情况,采取加热和搅拌的方法来缩短陈化时间。
陈化作用也能使沉淀变得更加纯净。这是因为大晶体的比表面较小,吸附杂质量小。同时,由于小晶体溶解,原来吸附、吸留或包藏的杂质,将重新溶入溶液中,因而提高了沉淀的纯度。但是,陈化对伴随有混晶共沉淀的沉淀反应来说,不一定能提高沉淀纯度,对伴随有后沉淀的沉淀反应,还会降低沉淀纯度。
二、无定形沉淀的沉淀条件
无定形沉淀的溶解度一般都很小,所以很难通过减小溶液的相对过饱和度来改变沉淀的物理性质。无定形沉淀的结构疏松,比表面积大,吸附杂质多,又容易胶溶,且含水量大,不易过滤和洗涤。对于无定形沉淀,主要是设法破坏胶体,防止胶溶、加速沉淀颗粒的凝聚,以便于过滤和减少杂质吸附。因此无定形沉淀的沉淀条件是:
①沉淀反应在较浓的溶液中进行,加入沉淀剂的速度适当快些。因为溶液浓度大,离子的水合程度较小,得到的沉淀比较紧密。但此时吸附的杂质多,所以在沉淀完后,需立刻加入大量热水冲稀并搅拌,使被吸附的杂质转入溶液。
②沉淀反应在热溶液中进行。这样可防止生成胶体,并减少杂质的吸附,还可使生成的沉淀结构紧密。
③溶液中加入适量的电解质,以防止胶体溶液的生成,但加入的物质应是可挥发性的盐类,如铵盐等。
④沉淀完毕后,应趁热过滤,不需陈化。否则,沉淀久置会失水而凝集得更紧密,使已吸附的杂质难以洗去。
此外,沉淀时不断搅拌,对无定形沉淀也是有利的。
三、均相沉淀法
在一般的沉淀方法中,沉淀剂是在不断搅拌下缓慢地加入,但沉淀剂的局部过浓现象仍很难避免。为此,可采用均相沉淀法。在这种方法中,加入到溶液中的试剂是通过化学反应过程,逐步地、均匀地在溶液内部产生出来(构晶阳离子或阴离子),使沉淀在整个溶液中缓慢地、均匀地析出,避免局部过浓现象。
如:用均相沉淀法沉淀Ca2+时,于含有Ca2+的酸性溶液中加入H2C204,由于酸效应的影响,此时不能析出CaC204沉淀。向溶液中加入尿素,加热至900C左右时,尿素发生水解:
CO(NH2)2+H20=C02↑+2NH3
水解产生的NH3均匀地分布在溶液的各个部分。随着NH3的不断产生,溶液的酸度渐渐降低,C202-4的浓度渐渐增大,最后均匀而缓慢地析出CaC204沉淀。在沉淀过程中,溶液的相对过饱和度始终是比较小的,所以得到的是粗大晶形的CaC204沉淀。
也可以利用配合物分解反应或氧化还原反应进行均匀沉淀。如利用配合物分解的方法沉淀SO2-4,可先将EDTA―Ba2+配合物加到含SO2-4的试液中,然后加氧化剂破坏EDTA,使配合物逐渐分解,Ba2+在溶液中均匀地释出,使BaS04均匀沉淀。
利用氧化还原反应的均匀沉淀法,如:
2AsO3-3-3Zr02++2N03一=(ZrO)3(As04)2↓+2NO-2
此法应用于测定ZrO2+,于AsO3-3的H2SO4溶液中,加入NO-3,将AsO3-3氧化为AsO3-4,使(ZrO)3(As04)2均匀沉淀。
四、有机沉淀剂的应用
有机沉淀剂与金属离子形成沉淀的选择性高,沉淀具有组成恒定、摩尔质量大、溶解度小、吸附无机杂质少等优点,虽然应用于重量分析中的有机沉淀剂并不多,但由于它克服了无机沉淀剂的某些不足之处,因而在分析化学中得到了广泛的应用。
有机沉淀剂与金属离子通常形成螯合物沉淀或缔合物沉淀。因此,有机沉淀剂也可分为生成螯合物的沉淀剂和生成缔合物的沉淀剂两类。
五、生成螯合物的沉淀剂
能形成螯合物沉淀的有机沉淀剂,至少有两个基团。一个是酸性基团,如一OH、一COOH、 ―SH、一S03H等;另一个是碱性基团,如―NH2、一NH一、=N一、=C=O及=C=S等。这些官能团具有未被共用的电子对,可以与金属以配位键结合形成配合物。
例如,Mg2+和8-羟基喹啉的反应为:
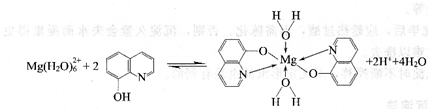
螯合物中虽然还有两个配位水分子,但因为整个螯合物不带电荷,其中又有相对摩尔质量较大的疏水基团――喹啉,所以生成微溶于水的螯合物沉淀。
六、生成缔合物的沉淀剂
阴离子和阳离子以较强的静电引力相结合而形成的化合物,叫做缔合物。某些有机沉淀剂在水溶液中能电离出大体积的离子,这种离子能与被测离子结合成溶解度很小的缔合物沉淀。例如,四苯硼酸阴离子与K+反应后生成溶解度很小的KB(C6H5)4,沉淀组成恒定,:烘干后即可直接称量,因此NaB(C6 H5)4常用作测定K+的沉淀剂。
重量分析结果的计算:
(1)化学因数
在重量分析中,多数情况下称量形式与被测组分的形式不同,需要将称量形式的质量换算成被测组分的质量。被测组分的摩尔质量与称量形式的摩尔质量之比是常数,这一常数称为化学因数或换算因数,用F表示。书写化学因数时,要注意用适当的系数使被测组分化学式与称量形式化学式中相应的原子数目相等。
应用实例:
用Bacl2将SO2-4沉淀成BaSO4,再灼烧、称量。由于BaS04沉淀颗粒较细,浓溶液中沉淀时可能形成胶体。BaSO4不易被一般溶剂溶解,不能进行二次沉淀,因此沉淀应在稀酸溶液中进行。溶液中不允许有酸不溶物和易被吸附的离子(如Fe3+、NO-3等)存在。
(2)硅酸盐中二氧化硅的测定
大多数硅酸盐不溶于酸,因此试样一般需用碱性溶剂熔融后,再加酸处理,此时金属元素成为离子溶于酸中,大部分硅酸根成胶状硅酸SiO2・Xh2O析出,少部分需经脱水后沉淀。经典方法是用盐酸反复蒸干脱水,准确度虽高,但操作麻烦、费时。近年来,用长碳链季铵盐作沉淀剂,它在溶液中成带正电荷胶粒,能将硅酸定量沉淀,所得沉淀疏松而易洗涤。得到的硅酸沉淀,需经高温灼烧才能完全脱水和除去带入的沉淀剂。但即使经过灼烧,一般仍带有不挥发的杂质(如铁、铝等的化合物)。在要求较高的分析中,于灼烧、称量后,加氢氟酸加热灼烧,使Si02转换成SiF4挥发逸去,再称量,从两次所得质量的差可计算出纯SiO2的质量。
(3)磷的测定
如测定磷酸二氢铵、磷、酸氢二铵中的有效磷,采用磷钼酸喹啉重量法。磷酸盐用酸分解后,可能生成偏磷酸HPO3或次磷酸H3PO2等,故在沉淀前要用硝酸处理,使之全部转变为正磷酸H3PO4。磷酸在酸性溶液中(7%~10%HNOa)与钼酸钠和喹啉作用,形成磷钼酸喹啉沉淀:
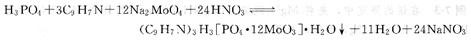
沉淀经过滤、烘干、除去水分后称量。
(4)其他
如丁二酮肟与Ni2+生成鲜红色沉淀,该沉淀组成恒定,经烘干后称量,可得到满意的测定结果。钢铁及合金中的镍即采用此法测定。
参考资料:分析化学







