首页>技术中心>技术资讯>定量分析中的分离方法及一般分析步骤(四)
定量分析中的分离方法及一般分析步骤(四)
发布时间:2017-09-01
2、制样
采取的原始试样通常不仅量太大,且颗粒大而不均匀,不适宜用作分析,因此应先将其制备成量少而高度均匀的分析试样。制备试样的方法分为粉碎、过筛、混匀和缩分四个步骤。
(1)粉碎
大块试样应用压碎机(如颚氏碎样机、球磨机等)粉碎成小的颗粒。在粉碎过程中,要尽量避免由于设备的磨损等原因而混进杂质,并应防止粉末的飞散。
(2)过筛
根据不同试样颗粒粒度的要求,选用标准筛进行过筛。凡不能过筛的必须重新回到第一步再粉碎。因为这部分颗粒往往具有不同的组成,所以必须反复的研磨,使所有细粒都能通过筛孔,以保证所得均匀样品能代表整个被测物料的平均组成。
(3)混匀
将过筛后的试样用一定的方法进行混合。
(4)缩分
常用的方法有四分法和棋盘法,通常用四分法。将混合均匀的试样堆成锥形,然后略微压平,通过中心分为四等份,把任何相对的两份弃去,其余相对的两份收集在一起再混匀,这样试样便缩减了一半,称为缩分一次。
八、试样的分解
除干法(如光谱法)分析外,通常先要将试样分解后制成分析试液。在分解试样时要注意的原则:试样分解必须完全,处理后的溶液中不得残留原试样的细屑或粉末;试样分解过程中待测组分不应挥发损失;不应引入被测组分和干扰物质。
由于试样的性质不同,分解的方法也有所不同。常用的分解方法有溶解和熔融两种。
(一)溶解分解法
采用适当的溶剂将试样溶解制成溶液,这种方法比较简单、快速。常用的溶剂有水、酸和碱等。能溶于水的试样一般称为可溶性盐类,如硝酸盐、醋酸盐、铵盐、绝大部分的碱金属化合物和大部分的氯化物、硫酸盐等。对于不溶于水的试样,则采用酸或碱作溶剂的酸溶法或碱溶法进行溶解,以制备分析试液。
1、酸溶法
酸溶法是利用酸的酸性、氧化还原性和形成络合物的作用,使试样溶解。钢铁、合金、部分氧化物、硫化物、碳酸盐矿物和磷酸盐矿物等,常采用此法溶解。常用的酸溶剂包括:
(1) 盐酸(HCl)
盐酸是分解试样的重要强酸之一,它可以溶解金属活动顺序中氢以前的金属及多数金属氧化物和碳酸盐。盐酸中的Cl-可以和许多金属离子生成稳定的络离子(如FeCl4-,SbCl4一等),对于这些金属的矿石是很好的溶剂。
(2)硝酸(HNO3)
硝酸具有强的氧化性,所以硝酸溶液兼有酸和氧化作用,溶解能力强而且快。除铂、金和某些稀有金属外,浓硝酸能溶解几乎所有的金属试样及其合金,大多数的氧化物、氢氧化物和几乎所有的硫化物都能溶解。但金属铁、铝、铬等被氧化后,在金属表面形成一层致密的氧化薄膜,使金属与酸隔离,不能继续起作用,这种现象称为金属的钝化。为了溶去氧化物薄膜,必须加非氧化性的酸如盐酸,才能达到溶样的目的。
(3)硫酸(H2SO4)
热浓硫酸具有强氧化性,除钡,锶,钙,铅外,其他金属的硫酸盐一般都溶于水。
因此,用硫酸可溶解铁、钴、镍、锌等金属及其合全和铝、铍、锰、钍、钛、铀等矿石。硫酸沸点高(338℃),可在高温下分解矿石,或用以逐去挥发性的酸(如盐酸,硝酸,氢氟酸)和水分。在加热蒸发过程中要注意在冒出SO3白烟时即应停止加热,以免生成难溶于水的硫酸盐。
(4)磷酸(H3PO4)
磷酸是中强酸,PO43-具有很强的络合能力,能溶解很多其他酸不溶的矿石,如铬铁、钛铁矿、铌铁矿和金红石(TiO2)等。在钢铁分析中含高碳、高铬、高钨的合金钢等,用磷酸溶样效果很好。但须注意加热溶解过程中温度不能过高,时间不能过长,以免析出难溶性焦磷酸盐。一般应控制在500~600℃,时间在5 min以内。
(5)高氯酸(HClO4)
在加热情况下(特别是接近沸点203℃时)是一种强氧化剂和脱水剂。铬、钨可被氧化成铬酸和钨酸,所以常用来溶解铬矿石、不锈钢、钨铁矿石等。在加热浓的高氯酸时,如遇有机物则由于剧烈的氧化作用而易发生爆炸,应特别注意。
(6)氢氟酸(HF)
它是较弱的酸,具有强的络合能力。氢氟酸主要用来分解硅酸盐,生成挥发性的SiF4。在分解硅酸盐和含硅化合物时,常与硫酸混合使用。
(7)混合酸
混合酸具有比单一酸更强的溶解能力,如单一酸不能溶解的HgS,可以溶解于混合酸王水中。
常用的混合酸有硫酸+磷酸、硫酸+氢氟酸、硫酸+高氯酸、盐酸+硝酸+高氯酸等。
2、碱溶法
碱溶法的溶剂主要为氢氧化钠和氢氧化钾。碱溶法常用来溶解两性金属铝、锌及其合金,以及它们的氧化物、氢氧化物等。
在测定铝合金中的硅时,用碱溶解使Si以SiO32-的形式转到溶液中。如果用酸溶解则Si可能以SiH4的形式挥发损失,影响测定结果。
(二)熔融分解法
熔融分解法是将试样与固体熔剂混合,在高温下加热使试样的全部组分转化成易溶于水或酸的化合物(如钠盐、钾盐、硫酸盐或氯化物等)。根据所用熔剂的化学性质,可分为酸熔法和碱熔法两种。
1、酸熔法
碱性试样宜采用酸性熔剂。常用的酸性熔剂有焦硫酸钾和硫酸氢钾,后者经灼烧后亦生成焦硫酸钾。

所以两者的作用是一样的。这类熔剂在300℃以上可与碱或中性氧化物作用,生成可溶性的硫酸盐。这种方法常用于分解氧化铝、氧化铬、四氧化三铁、氧化锆、钛铁矿、铬矿、中性耐火材料(如铝砂、高铝砖)及碱性耐火材料(如镁砂、镁砖)等。
用焦硫酸钾熔剂进行熔融时,温度不能过高,防止SO3过多过早地损失掉。熔融物冷却后用水溶解时应加入少量酸,以免有些元素(如钛、锆)发生水解而产生沉淀。
2、碱熔法
酸性试样宜采用碱熔法。如酸性矿渣、酸性炉渣和酸不溶性试样均可采用碱熔法,使它们转化为易溶于酸的氧化物或碳酸盐。
常用的碱性熔剂有无水碳酸钠(熔点850℃)、碳酸钾(熔点891℃)、氢氧化钠(熔点318℃)、过氧化钠(熔点460℃)和它们的混合熔剂等。这些熔剂除有碱性外,在高温下均可起氧化作用(自身氧化或空气氧化),可以把一些元素氧化成高价,如Cr3+和Mn2+可以氧化成Cr(Ⅵ)与Mn(Ⅶ),从而增强了试样的分解作用。有时为了增强氧化作用还加入硝酸钾或次氯酸钾,使氧化作用更为完全。
(1)无水碳酸钠或碳酸钾
常用来分解硅酸盐和硫酸盐等。分解反应如下:
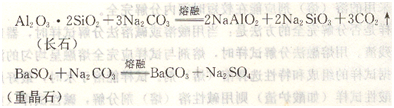
在熔融时常将碳酸钠与碳酸钾混合使用,可降低熔点到700℃左右。有时为了增强氧化性,采用碳酸钠和硝酸钾混合熔剂,可以使Crz0。转化为Na2CrOt,二氧化锰转化为过锰酸钠(Na2MnO4)。常用的混合熔剂还有碳酸钠+硫,用以分解砷、锑、锡的矿石,将它们转化为硫代硫酸盐。如锡石(SnO2)的分解反应为:
![]()
(2)过氧化钠
常用来分解含砷、锑、铬、钼、钒和锡的矿石及其合金。由于过氧化钠是强氧化剂,能把其中大部分元素氧化成高价状态。例如铬铁矿的分解反应为:
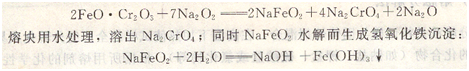
然后利用Na2CrO4溶液和氢氧化铁沉淀分别测定铬和铁的含量。
有时为了减缓氧化作用的剧烈程度,过氧化钠常与无水碳酸钠混合使用。用过氧化钠作熔剂时有机物不能存在,否则极易发生爆炸。
参考资料:分析化学







