滴定分析的计算(一)
发布时间:2017-09-01
按照国家标准GB 3100~3103―1993《量和单位》的规定,分析化学中的量和单位一律采用法定单位。
一、物质的量和摩尔
1、物质的量
物质的量是量的名称,符号为n,单位是摩[尔],符号为mol。根据GB 3102・8~1993规定,物质的量为基本量之一。物质的量是从系统中分子或其他基本单元数N这一角度出发的,用以反映物质共多少的物理量,即:

式中,L为阿伏加德罗(Avogadro)常数,换句话说,物质的量n是以阿伏加德罗常数为计数单位,来表示物质指定的基本单元多少的一个物理量。
例如:1 mol的氢分子有1个阿伏加德罗常数个氢分子。
1 mol的水分子有1个阿伏加德罗常数个H2O分子。
阿伏加德罗常数是一个很大的数,单位为每摩[尔](mol-1),其值随测量技术的提高而更趋于准确,GB 3102.8―1993中规定L=(6.022 136 7±0.000 003 6)×1023mol-1,一般用6.023×1023mol-1表示。
2、摩尔
摩尔(m01)是表示一系统的物质的量,该系统中所包含的基本单元数与0.012 kg碳-12的原子数目相等。l摩尔物质含有的基本单元数为6.023×1023。
在使用摩尔时,基本单元应予指明,可以是原子、分子、离子、电子及其他粒子或是这些粒子的特定组合。
二、摩尔质量
1、摩尔质量的定义
根据国家标准GB 3102.8 1993的规定,摩尔质量定义为:质量m除以物质的量n。符号为M,数学式为:
M=m/n
摩尔质量的单位为kg/mol,在分析化学中常用的单位还有g/mol和mg/mmol等。
如果摩尔质量MB的单位是g・mol-1,其数值则等于基本单元B的相对原子质量、分子质量或特定组合的相对质量。
摩尔质量M是物质的量n的一个导出量,故在使用中同样要指明基本单位。
2、摩尔质量、质量与物质的量的关系
物质的质量m、物质的量”与摩尔质量M,从摩尔质量定义出发三者之间的关系为:
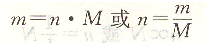
三、物质基本单元的确定
在应用物质的量及摩尔质量等导出量时,均需指明其基本单元。物质B的基本单元与参与化学反应相联系,同一物质在不同的化学反应中其基本单元是不同的。因此,基本单元的确定在滴定分析中非常重要。例如可以应用等物质的量的规则,使两反应物的基本单元数之比为1:1,从而简化计算。
在滴定反应中,根据滴定反应的不同类型,按习惯先确定各种常作为标准溶液的物质的基本单元,然后根据反应的计量关系,确定其他物质的基本单元。
物质B基本单元的选择,就等物质的量规则的要求来说是任意的,只要符合原子守恒、电荷守恒及化学反应方程式正确,就可以根据上述原则选择和确定物质B的基本单元,方法包括:
(1)以包括化学计量数在内的化学反应作为基本单元
例如:2NaOH+H 2SO4=Na2SO4+2H20
按上面的化学方程式的计量关系,NaOH的计量数为2,基本单元定为2NaOH;H2SO4的计量数为1,基本单元定为H2SO4,由于2NaOH的基本单元数与H2SO4的基本单元数相等,则两物质的物质的量相等(即等物质的量规则),即:
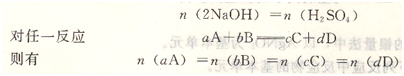
(2)按分析化学习惯选择基本单元







