首页>技术中心>技术资讯>动物源食品中13种卢-内酰胺类药物残留检测方法――超高效液相色谱一串联质谱法(一)
动物源食品中13种卢-内酰胺类药物残留检测方法――超高效液相色谱一串联质谱法(一)
发布时间:2017-09-01
1、安全要求
实验操作时穿工作服、戴口罩和手套;提取和净化操作都应在通风橱中进行,避免溶剂气体吸入和皮肤接触;废弃的化学试剂收集到专用容器中集中处理。
2、急救措施
皮肤接触到有机溶剂或酸、碱溶液后用清水清洗,有机溶剂或酸、碱溶液溅入眼中用清水灌洗。
3、适用范围
该标准操作规程适用于牛奶、猪、鸡肌肉和肾脏中青霉素G、青霉素V、阿莫西林、羧苄西林、氨苄西林、苯唑西林、氯唑西林、萘夫西林、头孢喹肟、头孢氨苄、头孢拉定、头孢唑啉和头孢哌酮单个或多个药物残留量的检测。
4、职责
进行该项检验的检验员必须按该标准操作规程进行检验,质量监督员负责监督该标准操作规程的正确执行。
5、检测原理
供试样品中的残留药物用水和乙腈提取后,用正己烷去除脂肪,再用C18固相萃取柱去除杂质,浓缩后供超高效液相色谱-串联质谱法测定。
6、方法灵敏度
青霉素G、青霉素V、阿莫西林、羧苄西林、氨苄西林、苯唑西林、氯唑西林、萘夫西林、头孢喹肟、头孢氨苄、头孢拉定、头孢唑啉和头孢哌酮在牛奶、猪、鸡肌肉和肾脏中的检测限为1μg/kg,定量限为2μg/kg。
7、注意事项
C18柱活化后要保持柱床湿润,避免出现干涸现象。
8、材料、仪器、试剂的准备及基本要求
除特别注明外,以下所用试剂均为分析纯;水为符合GB/T6682规定的一级水。
8.1对照品、试剂和药物储备液、工作液准备
8.1.1青霉素G、青霉素V、阿莫西林、羧苄西林、氨苄西林、苯唑西林、氯唑西林、萘夫西林、头孢喹肟、头孢氨苄、头孢拉定、头孢唑啉和头孢哌酮对照品 纯度均大于95.0%
8.1.2乙腈 色谱纯
8.1.3正己烷
8.1.4 甲酸
8.1.5标准储备液(1mg/mL) 准确称取适量的青霉素G、青霉素V、阿莫西林、羧苄西林、氨苄西林、苯唑西林、氯唑西林、萘夫西林、头孢喹肟、头孢氨苄、头孢拉定、头孢唑啉和头孢哌酮对照品,用50%乙腈水溶液溶解稀释,分别配制成1mg/mL的标准储备液。4℃下保存,有效期为1周。
8.1.6混合标准工作液(1μg/ mL) 分别准确吸取0.1mL的青霉素G、青霉素V、阿莫西林、羧苄西林、氨苄西林、苯唑西林、氯唑西林、萘夫西林、头孢喹肟、头孢氨苄、头孢拉定、头孢唑啉和头孢哌酮标准储备液至10mL容量瓶中,用水稀释至刻度,混匀即得。4℃下保存,有效期为l周。
8.2仪器和设备
8.2.1超高效液相色谱一串联质谱仪(配电喷雾离子源)
8.2.2分析天平 感量0.00001g
8.2.3天平 感量0.0lg
8.2.4高速离心机
8.2.5涡旋混合器
8.2.6水平振荡器
8.2.7固相萃取装置
8.2.8.BakerBond C18固相萃取柱:1000mg/6mL,或相当者
8.2.9氮吹仪
8.2.10滤膜0.22μm
9、检验步骤
9.1试样的制备
9.1.1取均质的供试样品,作为供试试料。
9.1.2取均质的空白样品(2±0.02)g,作为空白试料(阴性对照)。
9.1.3取均质的空白样品(2±0.02)g,添加200ng/mL标准工作液0.1mL,作为空白添加试样(阳性对照)。
9.2提取
9.2.1 称取(2±0.02)g匀质样品,置于50mI.离心管内,加水2mL和乙腈8mL(牛奶样品直接加乙腈8mL),涡旋混合后中速振荡5min,10000r/min离心10min。
9.2.2取上清液于另一50mI.离心管内,加正己烷5mL,涡旋混合后中速振荡5min,5000r/min离心5min,弃上层溶液,下层溶液作为备用液。
9.3净化
9.3.1 C18小柱依次用乙腈5mL、水10mL活化。
9.3.2取全部备用液过柱同时收集于15mL玻璃试管内,挤干。
9.3.3于400C下氮气吹至体积小于1mL,用水定容至1mL,充分涡旋混匀,转移至1.5mL塑料离心管内,15000r/min离心10min,取适量上清液过滤膜后,供超高效液相色谱-串联质谱仪测定。
9.4测定
9.4.1色谱条件
9.4.1.1 色谱柱:BEH C1850mm×2.1mm(i.d.),粒径1.7μm,或相当者;
9.4.1.2柱温:30℃;
9.4.1.3进样量:10μL;
9.4.1.4流动相A:0.1%甲酸乙腈溶液;
流动相B:0.1%甲酸水溶液;
流动相梯度洗脱条件见表1。

9.4.2 质谱条件
9.4.2.2 离子源参考参数,见表2。

9.4.2.2质量分析器参考参数见表3。

9.4.2.3 光电倍增器电压:650V
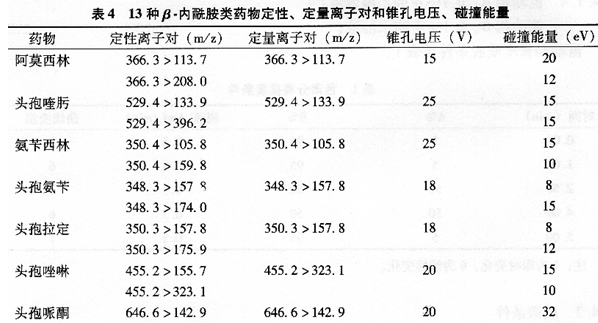
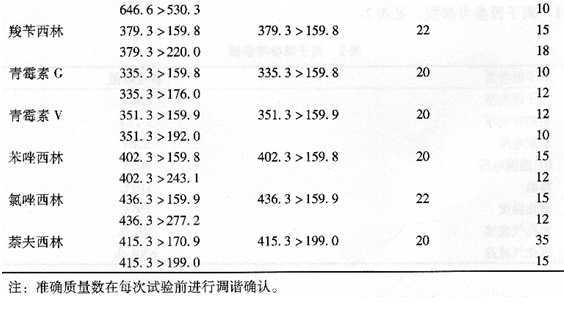
9.4.2.4 定性、定量离子对、锥孔电压和碰撞能量见表4。
参考资料:兽药残留检测标准操作规程







