配位滴定方式及其应用
发布时间:2017-09-01
在配位滴定中,采用不同的滴定方式,不仅可以扩大配位滴定的应用范围,而且可以提高配位滴定的选择性。
1、直接滴定法
这种方法是用EDTA标准溶液直接滴定待测金属离子。采用直接滴定法必须满足下列条件:
①被测离子浓度CM及其与EDTA形成的配合物的条件稳定常数K,MY的乘积应满足准确滴定的要求,即lgcK’MY≥6。
②被测离子与EDTA的配位反应速率快。
③应有变色敏锐的指示剂,且不发生封闭现象。
④被测离子在滴定条件下,不会发生水解和沉淀反应。
直接滴定法操作简单,一般情况下引入的误差较少,因此只要条件允许,应尽可能采用直接滴定法。表列出了EDTA直接滴定一些金属离子的条件。
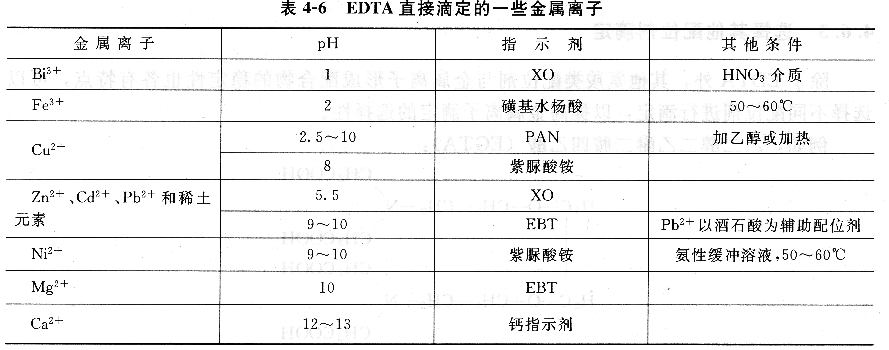
例如,水硬度的测定就是直接滴定法的应用。水的总硬度是指水中钙、镁离子的含量,由镁离子形成的硬度称为镁硬,由钙离子形成的硬度称为钙硬。测定方法如下:先在pH≈10的氨缓冲溶液中,以EBT为指示剂,用EDTA滴定,测得的是Ca2+、Mg2+总量。另取同量试液,加入NaOH调节pH>12,此时Mg2+以Mg(OH)2沉淀形式被掩蔽,用钙指示剂,EDTA滴定Ca2+,终点由红色变为蓝色,测得的是Ca2+的含量。前后两次测定之差,即可得到Mg2+含量。
2、返滴定法
返滴定法是在试液中先加入已知过量的EDTA标准溶液,然后用其他金属离子标准溶液滴定过量的EDTA,根据两种标准溶液的浓度和所消耗的体积,即可求得被测物质的含量。
例如,EDTA滴定A13+时,因为Al3+与EDTA 的反应速率慢;酸度不高时,A13+水解生成多核羟基配合物;A13+对二甲酚橙等指示剂有封闭作用,因此不能直接滴定A13+。采用返滴定法即可解决这些问题,方法是先加入已知过量的EDTA标准溶液,在pH≈3.5(防止A13+水解)时,煮沸溶液来加速A13+与EDTA的配位反应。然后冷却,并调节pH至5~6,以保证A13+与EDTA配位反应定量进行。以XO为指示剂,此时A13+已形成A1Y配合物,不再封闭指示剂。过量的EDTA可用Zn2+或Pb2+标准溶液返滴定,即可测得A13+的含量。
特别注意的是,作为返滴定的金属离子,与EDTA配合物的稳定性要适当。即要有足够的稳定性以保证滴定的准确度,但不宜超过被测离子与EDTA配合物的稳定性,否则在滴定过程中,返滴定剂会将被测离子置换出来,造成测定误差,而且终点也不敏锐。
返滴定法主要用于以下情况:
①被测离子与EDTA反应速率慢。
②被测离子对指示剂有封闭作用,或者缺乏合适的指示剂。
③被测离子发生水解等副反应。
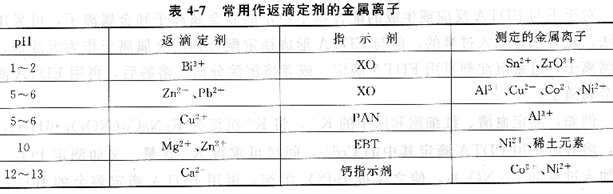
表列出了一些常用作返滴定剂的金属离子。
3、置换滴定法
利用置换反应,置换出相应数量的金属离子或EDTA,然后用EDTA或金属离子标准溶液滴定被置换出来的金属离子或EDTA,这种方法称为置换滴定法。
(1)置换出金属离子
当被测离子M与EDTA反应不完全或形成的配合物不稳定时,可用M置换出另一配合物(NL)中的N,然后用EDTA滴定N,即可求得M的含量。
M+NI=ML+N
例如,Ag+与EDTA的配合物不稳定,不能用直接法滴定,但是将Ag+加入到Ni(CN)2-4溶液中,则Ni2+被置换出来:
2Ag十+Ni(CN)2一4=2Ag(CN)2-+Ni2+
在Ph=10的氨性缓冲溶液中,以紫脲酸铵作指示剂,用EDTA滴定置换出来的Ni2+,即可求得Ag+的含量。
(2)置换出:EDTA
先将被测离子M与干扰离子全部用EDTA配位,加入选择性高的配位剂L,生成ML,从而释放出与M等物质的量的EDTA:
MY+L=ML+Y
反应完全后,再用另一金属离子标准溶液滴定释放出来的EDTA,即可测得M的含量。
4、间接滴定法
对于不与EDTA反应或生成的配合物不稳定的非金属离子和金属离子,可采用间接滴定法。该方法是加入过量的、能与EDTA形成稳定配合物的金属离子作为沉淀剂,以沉淀待测离子,过量沉淀剂再用EDTA滴定。或者将沉淀分离、溶解后,再用EDTA滴定其中的金属离子。
参考资料:分析化学







