电分析化学法(一)
发布时间:2017-09-01
一、引言
电分析化学法是以测量某一化学体系的电响应为基础建立起来的一类分析方法。它是通过测量电化学过程中的某些物理量,如电位、电流、电导和电量等,求得物质的含量或表征某些电化学性质。按电化学参数之间的关系,电分析化学可分为电导分析法、电位分析法、电解与库仑分析法、极谱分析法、伏安分析法等。电化学方法的仪器较简单,测定速度快,不仅可以进行组分含量分析,还可以进行价态、形态分析以及用于研究电极过程动力学、氧化还原过程、催化过程、有机电极过程、吸附现象等。电分析化学法在科学研究和生产控制中是一种很重要的工具。
电位分析法是利用电极电位测定物质活度或浓度的电分析化学方法,可分为直接电位法和电位滴定法。在溶液中插入一支工作电极和一支参考电极,通过测定它们之间的电位差进行溶液中待测物质浓度的方法称为直接电位法;而利用在滴定过程中电位差的变化来确定滴定终点的方法称为电位滴定法。直接电位法比较简便,常用于溶液pH值的测定以及一些阳离子或阴离子浓度的直接测定,但其准确度不高,需同时控制体系的离子强度及pH值;电位滴定法具有分析准确度高、适用范围广等优点,广泛用于酸碱滴定、氧化还原滴定、沉淀滴定以及络合滴定等。特别是对于一些滴定突跃小、不能用指示剂准确指示终点的场合,或一些体系有色或混浊、指示剂不适用的场合,以及对多组分进行连续、分别滴定的场合,用电位滴定法可获得理想的结果。
当直流电通过某种电解质溶液时,电极与溶液界面发生化学反应引起溶液中物质的分解,这种现象称为电解。电解分析法是将待测溶液置于电解装置中进行电解,使被测离子在电极上以金属或其他形式析出,根据电解引起的重量增加求算出待测组分含量的方法。这种方法的实质是重量分析法,因此这种电解分析法又称为电重量分析法。库仑分析法是在电重量分析法基础上发展起来的一种电解分析方法,它是通过测量待测物质在100%电流效率下电。解所消耗的电量来进行定量分析的方法。按照实验所控制的参量不同,电解分析法可分为控制电位和控制电流两种方式。
极谱分析法是基于可还原物质或可氧化物质在特殊的电解池中所获得的电流电压曲线进行物质的定量或定性分析方法。各种极谱技术,如示波极谱法、脉冲极谱法以及极谱催化波技术的出现,使得极谱分析法成为常用的仪器分析方法。它具有快速、灵敏、准确、设备简单等优点,已广泛用于矿物、冶金、超纯材料、环境分析等领域。
伏安法和极谱分析法都是通过电解过程中所得的电流一电压或电位~时问曲线进行分析的方法,它们的区别在于伏安法使用的极化电极是固体电极或表面不能自动更新的液体电极,而极谱分析法使用的是表面能够周期性更新的滴汞电极。
二、方法原理
1、电位分析法的原理
电位分析法的基本原理是利用电极电位与溶液中某组分(或某些组分)浓度的相关性进行定量分析的方法。电极电位是通过测定置于溶液中的工作电极和参比电极之间的电位差获得的。工作电极是指其电极电位随待测对象浓度变化的电极,而参考电极则是在测定过程中电位保持恒定的电极。
电位分析法主要由两种方式进行,即直接电位法与电位滴定法。直接电位法的应用包括用玻璃电极测定溶液的pH值、用离子选择性电极测定溶液中离子浓度以及某些场合用选择性传感电极进行物质浓度的在线监测。用直接电位法时,如在测定中保持溶液的离子强度始终不变,即在作工作曲线及测定样品时均保持溶液中相同的离子强度,这样活度系数的影响可合并入常数项,电位与离子浓度对数呈线性关系,可直接测定样品中离子浓度。共存离子的存在对离子选择性电极的响应值有影响,因而使测量结果产生偏差,严重时甚至不能得出正确结果。溶液的pH值也影响电极的响应值,在直接电位测定时需要保持体系的pH值恒定。因此,在直接电位分析法中常常加入一种总离子强度调节缓冲液,其作用是保持溶液离子强度和pH值为定值,同时还可消除共存离子的干扰,从而获得准确可靠的测量结果。
电位滴定法是通过滴定过程中电极电位的变化来确定终点的滴定方法。电位滴定分析中测量电位的目的仅仅是通过在化学计量点处发生电位突变或曲线转折来判别滴定终点的位置,而不是通过测量电位来求物质的浓度。电位滴定法关心的是滴定终点附近的电位变化,而不是电位的绝对值。因为活度系数、液接电位以及某些不影响滴定反应的共存离子不干扰测定,所以其准确度优于直接电位法。电位滴定法配合各种指示电极可用于酸碱滴定、氧化还原滴定、络合滴定、沉淀滴定,并可用于无机、有机及生化物质的测定。
2、电极电位
IUPAC规定任何电极的电位是该电极与标准氢电极构成的原电池所测得的电动势。电子通过外电路由标准氢电极流向该电极,该电极的电极电位定义为正值;电子通过外电路由该电极流向标准氢电极,电极电位定义为负值。在温度为298.15K,以水为溶剂,氧化态和还原态活度等于1时的电极电位称为标准电极电位。
3、 Nernst方程式
Nernst方程式表示了电极电位与溶液中对应离子活度之间的关系,对于一个氧化还原体系:

式中,ψ’是标准电极电位;R是摩尔气体常数;T是热力学温度;F是Faraday常数;z是电极反应过程中转移的电子数;a0和aR是氧化态和还原态的活度。在250C时,上述方程式可写成:
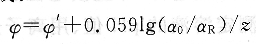
在实际工作中,常设法使标准溶液与被测溶液的离子强度相同,这时可以用浓度代替活度。
4、参比电极和工作电极
参比电极是用于测量其他电极电位的电极。参比电极应具备电位已知、恒定、重现、温度系数小、电流通过时极化电位及机械扰动的影响小等特性。常用参比电极有标准氢电极、甘汞电极和银/氯化银电极等。
标准氢电极(NHE)是由一片表面涂有薄层铂黑的铂片浸在氢离子活度等于1tool/L的水溶液中构成的。通入压力为101325Pa的氢气,让铂电极表面上不断有氢气泡通过。电极反应为:
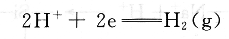
人为规定在任何温度下,标准氢电极的电极电位为零。标准氢电极的电极电位虽然稳定,但在使用中需要氢气,因此不方便。
甘汞电极是由金属汞和其难溶盐氯化亚汞(Hg2Cl2,甘汞)以及含Cl的电解质溶液组成的。其电极反应为:
![]()
它的电位取决于电极表面电极Hg2+2的活度。在250C时,它的相对于标准氢电极的电位为O.242V(饱和KCl溶液)。饱和甘汞电极易于制备和维护,是最常用的一种参比电极。
银/氯化银电极由涂有难溶氯化银的银丝浸入到含Cl一的电解质溶液中构成,其电极反应为:
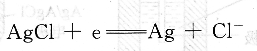
电极电位由溶液中的Cl一活度所决定,氯离子活度为1时的电极电位称为Ag/AgCl电极的标准电位。在250C时,1tool/L的KCl溶液中Ag/AgCl电极的电极电位为O.2355V。Ag/AgCl参比电极结构牢固,使用方便,特别是在非水溶剂中使用比甘汞电极优越。
工作电极是一种能反映离子浓度、发生所需的电化学反应或响应激发信号的电极。电位分析中常用的工作电极有离子选择性电极、流动载体电极、金属基电极等。
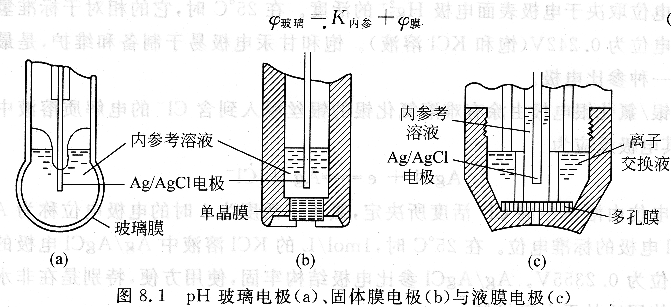
离子选择性电极是一种电化学传感器,敏感膜是其主要组成部分,主要有玻璃电极和晶体膜电极。
(1)玻璃电极
玻璃电极是对氢离子活度有选择性响应的电极。它的构造见图8.1(a),是由特殊玻璃制成的薄膜球,球内密封0.1mol/L HCl为内参考溶液。插人表面有氯化银的银丝,构成Ag/AgCl内参考电极。pH玻璃电极的玻璃膜由Sio2和Na2O以及CaO熔融制成。由于Na2O的加入,Na+取代了玻璃中一部分Si(Ⅳ)的位置。由于Na+与O一之间呈离子键性质,因此形成可以进行离子交换的点位:
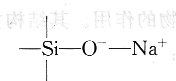
当电极浸入水溶液中,玻璃外表面吸收水产生溶胀,溶胀层允许氢离子扩散进入玻璃的结构空隙并与Na+发生交换反应:
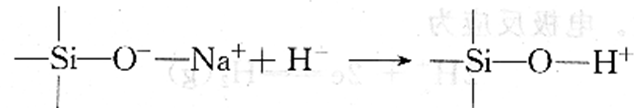
当玻璃电极外膜与待测溶液接触时,由于溶胀层表面与溶液中的氢离子活度不同,氢离子便从活度大的相向活度小的相迁移。从而改变了溶胀层和溶液两相界面的电荷分布,产生外相界电位。玻璃电极内膜与内参考溶液同样也产生内相界电位。玻璃电极内部插有内参比电极,如银/氯化银电极,因此整个玻璃电极的电位应是内参比电极与膜电位之和:
除氢离子在玻璃电极膜上有选择性响应外,当溶液中Na+,K+等离子浓度很大时,也要产生响应值,这将对pH值测定产生干扰。如果改变玻璃膜的组成,例如,加入不同量的Al2O3,可使电极对Na+,K+,Ag+等有选择性响应而成为钠电极、钾电极或银电极。但这些电极的电位仍然受溶液氢离子浓度的影响,使用中通常选择在高pH值并保持不变,因此可选择性地测定这些元素。
参考资料:现代仪器分析实验与技术







