非水溶液的酸碱滴定(一)
发布时间:2017-09-01
酸碱滴定一般都在水溶液中进行。但是许多有机试样难溶于水;许多弱酸、弱碱,当它们的离解常数小于10-8时,在水溶液中不能直接滴定;另外,一些酸(或碱)的混合溶液在水溶液中不能分别滴定,因此在水溶液中进行的酸碱滴定有一定局限性,若采用非水滴定就可以克服上述困难,扩大酸碱滴定的应用范围。
一、非水滴定中的溶剂
1、溶剂的分类
根据酸碱质子理论,可将非水溶剂分为质子溶剂和非质子溶剂两大类。
(1)质子溶剂
能给出质子或接受质子的溶剂,称为质子溶剂。其最大特点是在溶剂分子问有质子转移,能发生质子自递反应。根据它们酸碱性的强弱,又分为以下3类。
①两性溶剂:既易给出质子又易接受质子的溶剂,又称为中性溶剂。其酸碱性与水相似。醇类一般属于两性溶剂,如甲醇、乙醇、丙醇、乙二醇等。两性溶剂适用于滴定不太弱的酸、碱的介质。
②酸性溶剂:给出质子的能力较强的溶剂,如甲酸、醋酸、丙酸等,酸性溶剂适于作为滴定弱碱性物质的介质。
③碱性溶剂:接受质子的能力较强的溶剂,如乙二胺、丁胺、乙醇胺等,碱性溶剂适于作为滴定弱酸性物质的介质。
(2)非质子溶剂
非质子溶剂的特点是没有给出质子的能力,分子问没有质子的转移,不能发生分子的自递反应。但是这类溶剂可能具有接受质子的能力,根据溶剂接受质子能力的不同,可进一步将它们分为两类。
①偶性亲质子溶剂:溶剂分子中无转移性质子,但却有较弱的接受质子倾向和形成氢键的能力,如酮类、酰胺类、吡啶类、脂类等。这类溶剂具有一定碱性却无酸性,适合作为弱酸的滴定介质。
②惰性溶剂:溶剂分子几乎没有接受质子的能力。不参与酸碱反应,也无形成氢键的能力,但能起溶解、分散和稀释溶质的作用,这种溶剂称惰性溶剂,如苯、四氯化碳、氯仿、正己烷等。在惰性溶剂中,质子转移反应直接发生在被滴物与滴定剂之间。
应当指出,溶剂的分类是一个比较复杂的问题,目前有多种不同的分类方法,但都各有其局限性。实际上,各类溶剂之间并无严格的界限。
(1)溶剂的解离性
除惰性溶剂外,非水溶剂均有不同程度的解离,存在下列平衡:
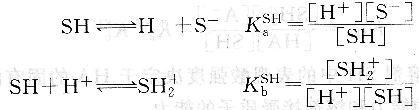
式中,KaSH为溶剂的固有酸度常数,反映溶剂给出质子的能力;KaSH为溶剂的固有碱度常数,反映溶剂接受质子的能力。
溶剂的自递反应为:2SH⇌sH2++S-
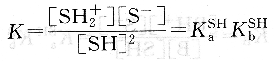
由于溶剂自身解离极微,且溶剂是大量的,故[SH]可看作是定值,则得:
Ks=[SH2+][S-]=KaSHK[SH]2
式中,Ka称为溶剂的自身离解常数或离子积。如乙醇的质子自递反应为:
2C2H50H⇌C2H50H2++C2H50-
则质子自递常数Ks=[C2 H5 OH2+][C2 H5 0-]=7.9×1-20加,而水的质子自递常数Ks=[H30+][OH-]=1.0×10-14。
在一定温度下,不同溶剂因其解离程度不同而具有不同的质子自递常数。溶剂质子自递常数Ks值的大小对滴定突跃范围有一定的影响。溶剂的自身离解常数越小,突跃范围越大,滴定终点越敏锐。下面以水和乙醇两种溶剂进行比较。
在水溶液中,以O.1m01・L-1的NaOH溶液滴定同浓度的一元强酸,当滴定至化学计量点前O.1%时,pH=4.3;化学计量点后0.1%时,pOH=4.3,pH=14―4.3=9.7,滴定突跃范围为4.3~9.7,有5.4个pH单位的变化。
在乙醇溶剂中,C2 H5 OH2+相当于水中的H3 O+,C2 H5 O-相当于0H-。若以O.1mol・L-1C2H50Na溶液滴定酸,当滴定到化学计量点前O.1%时,pH*=4.3(这里pH*代表pC2 H5 OH2)。而滴定至化学计量点后0.1%时,pC2 H5 0=4.3,因为pC2H50H2+pC2H50=19.1,此时pH*=19.1―4.3=14.8。故在乙醇溶液中pH+的变化范围为4.3~14.8,有10.5个pH+单位的变化,比水为介质的溶液突跃范围大得多。由此可见,溶剂的自身离解常数越小,突跃范围越大,滴定终点越敏锐。因此,原来在水中不能滴定的酸碱,在乙醇中有可能被滴定。
(2)溶剂的酸碱性
溶剂的酸碱性对溶质酸碱性强弱有影响。若用HA代表酸或B代表碱,根据质子理论有下列解离平衡存在:
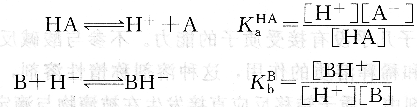
若将HA溶于质子溶剂sH中,则发生下列质子转移反应:
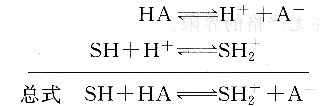
反应平衡常数,即溶质HA在溶剂SH中的表观解离常数为:
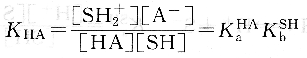
上式表明,酸HA在溶剂sH中的表观酸强度决定于HA的固有酸度和溶剂SH的碱度。即决定于酸给出质子的能力和溶剂接受质子的能力。同理,碱B溶于质子溶剂SH中,则发生下列质子转移反应:
SH+B⇌BH++S-
反应平衡常数KB为:
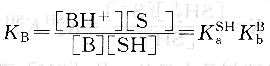
碱B在溶剂SH中的表观碱强度决定于B的固有碱度和溶剂SH的酸度。即决定于碱接受质子的能力和溶剂给出质子的能力。
由此可见,酸、碱的强度不仅与酸、碱自身给出、接受质子的能力有关,而且还与溶剂的接受、给出质子的能力有关。在非水滴定中,对于弱酸性物质,应选择碱性溶剂,使物质的酸性增加;对于弱碱性物质,应选择酸性溶剂,使物质的碱性增加。
参考资料:分析化学







