甲基橙离解常数的测定
发布时间:2017-09-01
1、实验目的
通过甲基橙离解常数的测定,掌握分光光度法测定一元弱酸离解常数的原理、方法和测定步骤。
2、实验原理
测定弱酸的离解常数是在分析化学研究工作中经常遇到的问题,分光光度法中所用的显色剂一般都是弱酸(或弱碱),在研究这类新试剂时,需用分光光度法测定其离解常数。
对于一元弱酸,在溶液中存在以下平衡:
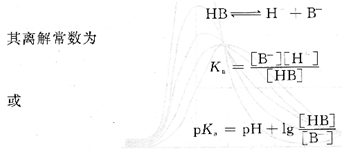
根据式(6.6),只要知道溶液的pH值和[HB]/[B一],就可以计算出离解常数Ka。pH值可用pH度计,[HB]和[B一]可从溶液的吸光度获得。对于浓度为c的一元弱酸,可以准备3种溶液:一种是强酸性溶液,此时可以认为溶液中全部以HB形态存在,溶液的吸光度AHB为:
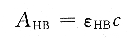
第二种溶液呈强碱性,HB完全离解成B-,溶液的吸光度AB-为:
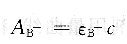
如果溶液的pH值在pKa附近,HB和B一在溶液中共存,此时的吸光度AB-为:
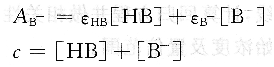
由式(6.8)~式(6.11),不难得到:
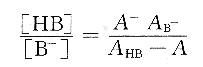
代入式(6.7),得到:
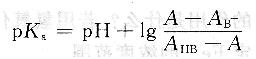
由测得的溶液的pH、AHB、AB-和A,就可算出一元弱酸HB的离解常数。对于弱碱也有类似的算法。
甲基橙为一元弱酸,当甲基橙溶液在pH值为3.1~4.4时,存在以下平衡:
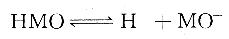
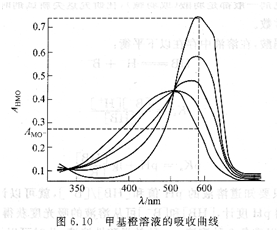
在某一浓度下,不同pH值的溶液中,甲基橙有图6.10所示的吸收光谱。最高曲线为酸式(HMO)的吸收曲线,最低曲线为碱式(MO-)的吸收曲线,其他曲线为HMO和MO-共存时的曲线,它们的形状与溶液的pH值有关。从图6.10可以得到AHMO和AMO一,以及不同pH值时所对应的A值,代人式(6.13),得到一组Pka值,取其平均值。
3、仪器与试剂
仪器:岛津UV-2100紫外-可见分光光度计;
pH酸度计,
容量瓶:50mL 7个;
移液管:5mL,10mL各1支;
试剂:甲基橙溶液(2×10-4mol/L):称取65.4mg甲基橙,溶于水后,稀释至1000mL;
KCl溶液:2.5mol/L;
HCl溶液:2mol/L;
氯乙酸一氯乙酸钠缓冲溶液:总浓度为0.50mol/L,pH值分别为2.7,3.0和3.5;
HAc-Ac一缓冲溶液:总浓度为0.50mol/L,pH值分别为4.0,4.5和6.0。
4、实验内容与步骤
(1)溶液配制
取7个50mL容量瓶,编号,按表6.3制备测定溶液。用水稀释至刻度,摇匀,用pH计精确测定溶液的pH值。
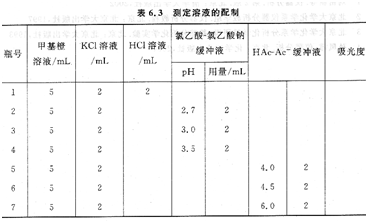
(2)吸光度测定
用lcm吸收池,以水作参比,测定各溶液的吸光度,记下各测定结果。
5、注意事项
(1)pH值的测定应精确到小数点后第二位。
(2)溶液的配制将直接影响测定结果,容量瓶中甲基橙的含量尽可能相同。
6、数据处理
用测得的吸光度值和pH值,通过上述公式计算出甲基橙的离解常数Ka。
参考资料:现代仪器分析实验与技术







